
ARTÍCULO ORIGINAL
Características biológicas y moleculares de
la CD66c e importancia en el pronóstico de la leucemia linfoblástica
aguda
Biological and molecular characteristics of CD66c and its importance in the prognosis of acute lymphoblastic leukemia
Julia Ximena Mejía Buri 1,a, Gabriele Davide Bigoni Ordóñez 2,b
1
Universidad Católica de Cuenca, Cuenca, Ecuador.
2
Universidad de Cuenca, Cuenca, Ecuador.
a
Química Farmaceuta.
b
Doctor en Ciencias Bioquímicas, campo de conocimiento Biología Molecular.
RESUMEN
Este
estudio tiene como objetivo recopilar información sobre las características y
funciones de la molécula CD66c a través de la revisión en la literatura, así
como sobre su papel pronóstico cuando se expresa en la leucemia linfoblástica aguda (LLA). La LLA es una enfermedad
originada a partir de la proliferación maligna de células hematopoyéticas. Es
el cáncer más común en población pediátrica, con una supervivencia superior al
70 % a nivel mundial en países desarrollados. En pacientes adultos, la
enfermedad se presenta con mayor frecuencia en edades comprendidas entre los 20
y los 40 años, con un pronóstico desfavorable en esta población. Varios
estudios han evidenciado la presencia de la glicoproteína CD66c en la LLA,
describiéndola como un potencial marcador relacionado con alteraciones
genéticas, como BCR-ABL1, hiperdiploidía y
negatividad del gen de fusión TEL-AML1. El CD66c es miembro de la familia del
antígeno carcinoembrionario (ACE), se expresa en la
línea granulocítica y está implicado en funciones
como la adhesión celular, regulación de la expresión génica, migración y
transducción de señales.
Palabras
clave:
CD66c; pronóstico; leucemia; leucemia linfoblástica
aguda de células precursoras B (Fuente: DeCS -
BIREME).
ABSTRACT
This
study aims to gather information on the characteristics
and functions of the CD66c molecule through a literature review, as well as its prognostic
role when expressed in acute lymphoblastic leukemia (ALL). ALL is a disease originating from the malignant
proliferation of hematopoietic
cells. It is the most
common cancer in the pediatric population,
with a survival rate exceeding 70% globally in developed countries. In adult patients, the disease
most frequently occurs between the ages of 20 and 40, with an unfavorable
prognosis in this population.
Several studies have demonstrated the presence of the glycoprotein CD66c in ALL, describing it as a potential marker related to genetic alterations such as BCR-ABL1, hyperdiploidy, and TEL-AML1 fusion
gene negativity. CD66c is a
member of the carcinoembryonic antigen (CEA) family, expressed in the granulocytic lineage, and is involved in functions such as cell adhesion,
regulation of gene expression,
migration, and signal transduction.
Keywords: CD66c; prognosis; leukemia; precursor B-cell acute lymphoblastic leukemia (Source: MeSH - NLM).
Recibido:
28/05/24
Aceptado:
24/07/24
Publicado
en línea: 29/07/24
Citar como: Mejía Buri JX, Bigoni Ordóñez GD.
Características biológicas y moleculares de la CD66c e importancia en el
pronóstico de la leucemia linfoblástica aguda. Rev Peru Cienc
Salud. 2024; 6(3). doi:
https://doi.org/10.37711/rpcs.2024.6.3.544
INTRODUCCIÓN
La
leucemia es el cáncer más común en la población pediátrica, caracterizado por
la proliferación maligna de células hematopoyéticas que interrumpen su función
normal en la médula ósea, provocando insuficiencia medular (1). La
leucemia linfoblástica aguda (LLA) representa
alrededor de 3 a 4 casos por cada 100 000 niños, afectando más a los niños que
a las niñas, especialmente durante la adolescencia (2). En adultos,
la enfermedad es más frecuente entre los 20 y 40 años, aunque puede presentarse
ocasionalmente en edades avanzadas.
El
diagnóstico inicial se basa en signos clínicos, como fiebre, cansancio, anemia,
sangrado, dolor en las articulaciones, hepatomegalia y esplenomegalia, entre
otros (3). Posteriormente, se realizan diversos estudios de sangre,
incluyendo el hemograma, medulograma, biopsia de
médula ósea, inmunofenotipo por citometría
de flujo, cariotipo y análisis de biología molecular, para confirmar el tipo de
leucemia y la presencia de alteraciones específicas (4). La mayoría
de las células leucémicas presentan características normales y comunes de los
linajes hematopoyéticos, detectadas mediante diversos métodos de diagnóstico.
No obstante, también se puede observar una expresión de antígenos que no se
corresponde con el linaje al que se clasifican, lo que se conoce como
“expresión aberrante” o “infidelidad de linaje”. Por ejemplo, en casos de LLA
las células pueden expresar antígenos de linaje mieloide, mientras que en la
leucemia linfoblástica aguda (LMA) pueden presentar
antígenos de linaje linfoide B o T. Aunque el mecanismo subyacente de este
fenómeno no se conoce completamente, su observación tiene diversas
aplicaciones, especialmente en el contexto de la enfermedad mínima residual
(EMR) (5).
El
antígeno CD66c, perteneciente a la familia de los antígenos carcinoembrionarios,
se expresa en la línea granulocítica y desempeña
múltiples funciones biológicas fundamentales. Entre estas funciones destacan la
adhesión celular, la migración, la transducción de señales y la regulación de
la expresión génica celular. Además, se ha establecido una asociación entre el
antígeno CD66c y cambios genéticos específicos, como la presencia de BCR-ABL1, hiperdiploidía y la ausencia del gen de fusión TEL-AML1.
Estas interacciones genéticas arrojan luz sobre la relevancia de CD66c en la
patogénesis y progresión de ciertas condiciones malignas (6).
Esta
revisión bibliográfica se centró en el estudio del marcador CD66c en la LLA. En
esta enfermedad, el CD66c es considerado un marcador aberrante y su presencia
se relaciona con el pronóstico de la enfermedad, así como en ciertas
alteraciones genéticas. Además, se vincula su expresión con una eficacia
limitada del tratamiento, lo cual afecta las posibilidades de supervivencia de
los pacientes (7). En base a lo mencionado, el objetivo de este
estudio fue recopilar información sobre las funciones y características del
marcador CD66c mediante una revisión bibliográfica, así como sobre su
implicación en el pronóstico de la LLA.
MÉTODOS
Criterios de admisibilidad
El
trabajo consistió en una revisión bibliográfica, mas no sistemática; razón por
la cual los criterios de inclusión que se usaron para obtener la información
fueron el uso de las palabras claves que constan en la primera parte del
manuscrito y todas las publicaciones académicas que se encuentren, relacionadas
con las mismas. En cuanto a los criterios de exclusión, fueron desestimadas
aquellas publicaciones que no se relacionaban en forma directa con el marcador
CD66c.
Fuentes de información
Fueron
seleccionados los artículos científicos publicados en el periodo comprendido
entre 1963 y 2022, tanto en inglés como en español, que abordaran de manera
clara y concisa la descripción biológica y molecular del marcador CD66c, así
como su relación con el pronóstico en la leucemia linfoblástica
aguda de linaje B (LLA-B).
Estrategia de búsqueda
Los
estudios fueron agrupados de acuerdo al año de publicación, agrupando también
aquellos en los cuales fueron realizados exámenes de citometría
de flujo al diagnóstico de la enfermedad, de acuerdo al año en que estos fueron
publicados.
Proceso de recogida de datos
Se
llevó a cabo una investigación bibliográfica en bases de datos digitales, como PubMed, LILACS y Scielo, donde se
realizó una selección de búsqueda mediante el empleo de palabras clave y
operadores booleanos.
Síntesis de métodos
En
cuanto, a la metodología, fueron recopilados los datos de todos los artículos
que constan en la sección de la bibliografía y, con posterioridad, fue
realizada una síntesis de estos mediante el uso de mapas conceptuales y cuadros
sinópticos.
DESARROLLO Y DISCUSIÓN
Leucemia linfoblástica aguda
La LLA
es un tipo de cáncer que se origina en los glóbulos blancos, llamados
linfocitos, provocando la expansión clonal de una
célula progenitora linfoide inmadura y su posterior acumulación en la médula
ósea, sangre periférica y demás tejidos. La enfermedad progresa rápidamente y
puede causar la muerte después de meses si no es tratada de manera oportuna (8,9).
La
etiología de esta enfermedad no se conoce con exactitud, sin embargo, se han
considerado algunos factores relevantes que parecen jugar un papel clave, como
alteraciones genéticas, las cuales generan traslocaciones
cromosómicas responsables de la expresión aberrante de proteínas implicadas en
la diferenciación y activación celular. Factores medioambientales como la
exposición a radiaciones ionizantes también pueden facilitar el desarrollo de
leucemia, así como la presencia de ciertos virus (Epstein-Barr)
debido a una mayor susceptibilidad a sus efectos oncogénicos (10).
La
ausencia de regulación fisiológica, anomalías en la proliferación de leucocitos
y mecanismos de apoptosis anormales son características en las leucemias, que
son procesos neoplásicos clonales del tejido
hematopoyético. Su génesis está en la médula ósea y la ausencia de tratamientos
pueden provocar la muerte (11).
Clasificación de la LLA por marcadores inmunológicos
La LLA
es un conjunto diverso de neoplasias malignas que tiene en común un origen
linfoide (12). Todos los estudios que se realizan de manera
rutinaria, tanto de morfología como citoquímicos, se
consideran informativos en el diagnóstico de la enfermedad. Sin embargo, la citometría de flujo en la actualidad es casi esencial para
la determinación del linaje de las células y para establecer una diferencia
entre la LLA y ciertos tipos de LMA (13). En la sub-clasificación de
la LLA, la morfología ha sido reemplazada casi por completo por esta técnica,
por lo que se ha relacionado con algunos patrones que son reconocidos en la
progresión de la enfermedad y con ciertas anomalías genéticas. La citometría tiene un papel fundamental en la definición de
los subtipos que serán clínica y biológicamente relevantes, y que orientarán
hacia una terapia específica con la finalidad de que los pronósticos sean
favorables para los pacientes (14).
Las
células de la LLA suelen ocupar el denominado “hueco blástico”.
Estos linfoblastos muestran una expresión menor de
CD45 que los mieloblastos. Existen ciertos casos de
LLA que presentan algunos antígenos mieloides como: CD13, CD15 o CD33, en los
que la mieloperoxidasa (MPO) será negativa por
completo (15).
A pesar de que existe una expresión de antígenos de linajes diferentes, al diagnosticar y clasificar una leucemia se debe tomar en cuenta que el patrón de reactividad se basa en un panel de anticuerpos, antes que en un reactivo solitario (16). A continuación, se detalla la clasificación inmunológica de la LLA, de acuerdo al Grupo Europeo de Clasificación Inmunológica de Leucemias (EGIL) (17) (ver Tabla 1).

El
requisito fundamental para que se corrobore el linaje B, debe ser que exprese
el antígeno CD19; el mismo que tiene que ir a la par, por lo menos, con alguno
de los siguientes antígenos: CD79a citoplasmático, CD22 o CD10 (18,19).
Existen
otros antígenos que permiten la diferenciación de los subtipos de la LLA B:
- En la LLA PRO B CD10 es negativo, mientras que
para la LLA B común, las LLA PRE B y B madura es positivo.
- El IgM citoplasmático
se expresa en las LLA PRE B y B madura, pero es negativo en las LLA PRO-B y la
LLA B común (20).
Epidemiología de la LLA
La
Agencia Internacional para la investigación del Cáncer (IARC) de la
Organización Mundial de la Salud (OMS), es la encargada de recopilar los datos
a nivel mundial sobre enfermos de cáncer, que van a servir para realizar
investigaciones y formular políticas de prevención de esta enfermedad. Resulta
una tarea de grandes dimensiones y casi desafiante el cuantificar de modo
correcto y preciso la incidencia mundial y regional del cáncer, debido a que
gran parte de la población mundial no se encuentra completamente censada. La
mayor parte de la evidencia muestra que alrededor de dos tercios habitan en
ciudades con avisos incompletos de nacimiento y muerte, y hasta ¾ partes de
población en países donde no existe un registro de cáncer (21).
A
nivel mundial, la leucemia se encuentra en el décimo tercer lugar de neoplasias
diagnosticadas con mayor frecuencia y en el décimo lugar de las principales
causas de muerte, con un total de 305 000 muertes estimadas en el 2022. En
edades pediátricas la LLA ocurre con mayor frecuencia, observándose una mayor
incidencia en países de América Latina y Asia (22).
De
acuerdo al último informe emitido por la Organización Panamericana de la Salud
(OPS), el cáncer es una de las principales causas de mortalidad en los países de
América. En el año 2022 causó 1,4 millones de muertes, un 45,1 % de ellas en
personas menores de 69 años. El número de casos de cáncer en la región de las
Américas se estimó en 4,2 millones en 2022 y se proyecta que aumentará hasta
los 6,7 millones en 2045 (23).
En Ecuador, en el año 2022 se reportaron 1220 nuevos casos de leucemia, la cual se encuentra dentro de los 9 principales tipos de cáncer que afectan a la población en general, con una incidencia de 6,5 por cada 100 000 habitantes y una mortalidad de 4,6 % (24) (ver Figura 1).
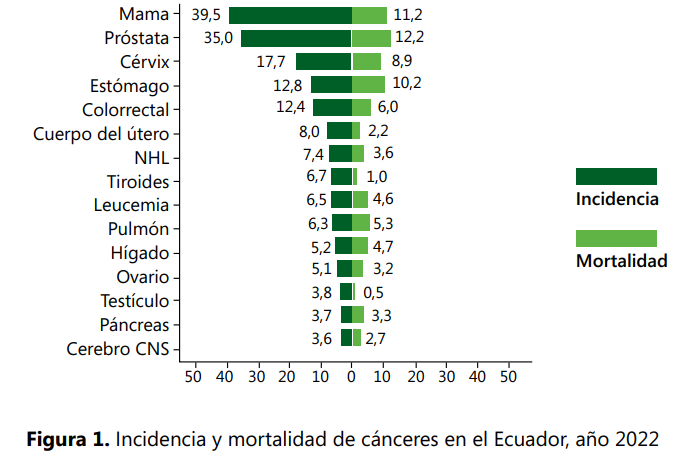
En
los casos de leucemias se presenta una variación claramente caracterizada por
diferentes factores, como geografía, raza, etnia, edad y género; tanto en la
incidencia como en la mortalidad. Con el paso de los años y los múltiples
estudios epidemiológicos que se han realizado, estos son indicadores de que los
factores de riesgo que se conocen son insuficientes para explicar la variación
que se observa en la aparición de la leucemia (25).
Dentro
de los diferentes estudios elaborados se ha hecho énfasis en el papel que
juegan los factores de riesgo ya conocidos, como radiación ionizante, agentes
quimioterapéuticos y exposiciones químicas específicas; así como también los
factores de riesgo que están bajo estudio, como agentes infecciosos, campos
electromagnéticos, tabaquismo y exposiciones químicas ocupacionales, que
intervienen en la leucemogénesis (26).
CD66c como miembro de la familia de antígenos ACE
A
mediados de la década de los 60 fue cuando se describió por primera vez el ACE
por Gold y Freeman, en extractos de tejidos de cáncer
de colon, donde se dio lugar a la hipótesis de que se trataba de un antígeno oncofetal, es decir, se expresa en la vida fetal,
desaparece en la vida adulta y reaparece en el cáncer (27). Varios años
después de este descubrimiento, el mismo grupo de investigadores pudo constatar
que el antígeno ACE podía también medirse en el suero de pacientes con
carcinoma colorrectal y otro tipo de carcinomas, con
la ayuda de un radio inmunoensayo que fuese sensible (28).
La
familia del ACE está compuesta por 18 genes activos que se ubican en el brazo
largo del cromosoma 19. Los principales miembros de esta familia incluyen al
número 6 de la molécula de adhesión celular, relacionada con el antígeno carcinoembrionario (CEACAM 6), conocido como CD66c, que es
el antígeno de reacción cruzada no específico (NCA), glicoproteína biliar (BGP,
CD66c) y miembro 2 de la familia del gen CEA (CGM2) (29).
Esta
familia de antígenos está conformada por un grupo de seis marcadores de
glicoproteínas altamente glicosiladas (CD66a, CD66b,
CD66c, CD66d, CD66e y CD66f) y se componen por el 50-75 % de carbohidratos y el
resto por proteínas. Estudios han descrito a la molécula CD66c como un marcador
potencial para detectar la LLA-B. Además, está demostrado que se expresa
aberrantemente en un nivel considerable de casos en esta patología e incluso es
más común que otros antígenos mieloides entre los que se incluyen CD13, CD15,
CD33 y CD65 (30-32).
Funciones y características biológicas- moleculares del
marcador CD66c
El
CD66c es un marcador que favorece la adhesión celular. Se identifica a este
antígeno como una proteína de 8 a 100 kDa, expresada
en la superficie de los granulocitos en sangre periférica, no se expresa en
monocitos, linfocitos, plaquetas, ni en células eritroides.
Las células mieloides presentes en la medula ósea normal también son capaces de
expresar este antígeno. Por su característica de adhesión celular, todos los
miembros de la familia ACE se consideran importantes y son utilizados como
marcadores tumorales para la determinación de cierto tipo de carcinomas (33).
El
CEACAM6 es el gen que codifica la proteína perteneciente a la familia del ACE,
cuyos miembros son glicoproteínas de superficie celular ancladas con glicosilfosfatidilinositol y se localizan en el locus
19q13.2, exón 6 (34,35).
El
marcador CD66c, además de ejercer la función de la adhesión celular, está
implicado en otras funciones biológicas, como la migración, transducción de
señales y regulación de la expresión génica. Todos los miembros de esta familia
intervienen como moduladores críticos en muchos procesos fisiológicos de vital
importancia, en la regulación de procesos inmunes; especialmente en los
relacionados con la inhibición de la diferenciación celular, de la apoptosis en
células del colon, interrupción en la polarización celular y arquitectura de
los tejidos. Todas las funciones se regulan por la activación de las vías de
señalización de las integrinas (37).
Los
antígenos CD66a, CD66b, CD66c y CD66d tienen una alta expresión en la
superficie de células mieloides, como mielocitos, metamielocitos,
y durante el proceso de maduración disminuyen progresivamente. Estos se
expresan en menor proporción en promielocitos
normales, mientras que en mieloblastos no se ha
descrito expresión. El CD66c se ha visto presente en niveles relativamente más
altos en pacientes con la LLA-B cromosoma Philadelphia
positivo (38), en donde se observa la traslocación
entre los cromosomas 9 y 22, cuya expresión tiene mayor proporción en adultos
que en niños (30 % vs. 5 %, respectivamente). El factor que determina la
presencia de este cromosoma en la población pediátrica se relaciona con la
edad, elevado número de leucocitos, blastosis
periférica y afectación del sistema nervioso central. La determinación
molecular de CD66c ofrece gran utilidad para la determinación de procesos de
activación y aumento de la frecuencia o extensión de la migración celular, que
es realizada por anticuerpos purificados (36).
La
detección del incremento de este antígeno se da con mayor frecuencia en varios
tipos de cáncer y su sobrexpresión a menudo se asocia con una baja respuesta al
tratamiento y a la disminución en la supervivencia de los pacientes (39).
El antígeno CD66c en las enfermedades hematológicas malignas se presenta en las
diferentes etapas de maduración de células mieloides, tanto en leucemias agudas
como en crónicas. Adicionalmente, inhiben una forma de muerte celular
programada inducida por la pérdida del anclaje de la célula a la matriz
extracelular; proceso conocido como apoptosis. La modulación de esta expresión
altera el fenotipo de las células cancerígenas, siendo este hecho observado por
primera vez en la leucemia mieloide crónica y en la LLA de la infancia. Por lo
tanto, se considera que el CD66c sería un marcador más específico para
determinar la agresividad en algunos tipos de cáncer (40).
CD66c como factor pronóstico en la LLA B
El
CD66c es un marcador de gran utilidad en el diagnóstico y pronóstico de la LLA-
B, debido a su actividad biológica. Se lo utiliza como un marcador de expresión
aberrante de antígeno mieloide (41). Varios estudios indican que el
antígeno CD66c se presenta en un porcentaje considerable entre los marcadores
expresados para el diagnóstico de la LLA-B, y está relacionado con la presencia
de diversas aberraciones cromosómicas (42).
La
Hiperdiploidía, que puede ir desde los 50 a los 60
cromosomas, es una de las aberraciones cromosómicas presentes en la LLA-B; con
frecuencia también se observa trisomía de los cromosomas 4, 10 y 17,
generalmente asociados con buenos pronósticos, siendo lo contrario a la
presencia del cromosoma Philadelphia, a
reordenamientos en 11q23, amplificación del gen AML1, hipodiploidía
y número modal cercano a la haploidía, que presentan
una evolución desfavorable de la enfermedad y, por consiguiente, esquemas más
severos de tratamientos (43).
En
pacientes con expresión del receptor de factor 2 de citoquinas (CRFL2), el gen
de fusión BCR-ABL e hipodiploidía, se ha evidenciado
un mal pronóstico, observándose una correlación entre estas anormalidades
genéticas y la expresión del marcador CD66c. La expresión de CRFL2 está
asociada a una mala evolución por inactivación de IKZF1 (Ikaros)
y mutaciones activadoras de JAK1/2. Mientras que en pacientes con hiperdiploidía se presenta un pronóstico terapéutico
favorable. Debido a la importancia clínica y pronóstica
de estas alteraciones, se debe hacer énfasis en la búsqueda y determinación de
aberraciones cromosómicas y su interacción con el marcador CD66c en pacientes
con la LLA-B (44-46).
El
antígeno CD66c también se lo ha asociado en varios estudios con el monitoreo de
pacientes, en el que otros marcadores moleculares, como BCR-ABL1 y TEL-AML1,
inicialmente son negativos. Debido a las múltiples ventajas, como alta
velocidad, simplificación en su operación, capacidad cuantitativa y buena
sensibilidad, se recomienda el uso de la citometría
de flujo para detectar marcadores de superficie en la evaluación de EMR en la
leucemia (47).
Estos
estudios hacen hincapié en la importancia de evaluar este marcador, debido a la
relación encontrada entre su expresión y una mala respuesta al tratamiento, lo
que permitirá garantizar un correcto abordaje terapéutico para los pacientes
con la LLA, tanto en el diagnóstico de la enfermedad como en el seguimiento.
Conclusiones
La
expresión aberrante del antígeno CD66c en células patológicas de línea linfoide
B en la LLA ha sido ampliamente estudiada en los últimos años. Diversos
estudios han demostrado que este marcador se encuentra presente en etapas
avanzadas de la maduración celular granulocítica, lo
que sugiere su potencial utilidad como herramienta de seguimiento de la
enfermedad. Si bien no se ha establecido aún como un indicador pronóstico específico,
su expresión en conjunto con otras alteraciones cromosómicas podría
proporcionar información valiosa acerca de la evolución y agresividad de la
enfermedad. En este sentido, se recomienda la realización de investigaciones
adicionales que permitan evaluar más exhaustivamente el papel de este biomarcador en el contexto de la LLA.
REFERENCIAS
1. Seth R, Singh A. Leukemias in Children. Indian J Pediatr. [Internet]. 2015 [Consultado el 21 de agosto de
2023];82(9):817-24. doi: 10.1007/s12098-015-1695-5
2. Arora B, Kanwar V. Childhood cancers in India: burden, barriers,
and breakthroughs. Indian J
Cancer. [Internet]. 2009 [Consultado el 21 de agosto
de 2023];46(4):257-9. doi: 10.4103/0019-509X.55543
3. Malard F, Mohty M. Acute lymphoblastic leukaemia. Lancet [Internet].
2020 [Consultado el 27 de agosto de 2023];395(10230):1146-1162. doi: 10.1016/S01406736(19)33018-1
4. Jiménez-Morales
S, Hidalgo-Miranda A, Ramírez-Bello J. Leucemia linfoblástica
aguda infantil: una aproximación ge- nómica. Bol Med Hosp Infant Mex.
[Internet]. 2017 [Consultado el 27 de agosto de 2023];74(1):13-26. doi: 10.1016/j.bmhimx.2016.07.007
5. Foà, Vitale, Meloni
V, Guarini, Propris D,
Elia, et al. GIMEMA Acute Leukemia
Working Party. Dasatinib as first-line treatment for adult
patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood [Internet]. 2011
[Consultado el 27 de agosto de 2023];118(25). doi:
10.1182/blood-2011-05-351403
6. Tang GS, Wu J, Liu M, Chen H, Gong SG, Yang JM,
et al. BCR-ABL1 and CD66c exhibit high
concordance in minimal
residual disease detection
of adult B-acute lymphoblastic leukemia. Am J Transl Res. [Internet]. 2015 [Consultado el 27 de agosto de
2023];7(3):632-9. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26045902/
7. González-Meneses
López A. Bases genéticas y moleculares en el cáncer infantil. Unidad de Dismorfología y Metabolopatías.
Hospital Universitario Virgen del Rocío. Universidad de Sevilla Pediatría
Integral [Internet]. 2016 [Consultado el 27 de agosto de 2023];20(6):359–366.
Disponible en: https://www.pediatriaintegral.es/wp-content/uploads/2016/xx06/01/n6-359-366_AntonioGlez.pdf
8. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. [Internet]. 2000
[Consultado el 27 de agosto de 2023];100(1):57-70. doi:
10.1016/s0092-8674(00)81683-9
9. Terwilliger T, Abdul-Hay M. Acute
lymphoblastic leukemia: a comprehensive review and 2017 update. Blood Cancer
J. [Internet]. 2017 [Consultado el 27 de agosto de 2023];7(6):e577.
doi: 10.1038/bcj.2017.53
10. López Meneses
G. Bases genéticas y moleculares en el cáncer infantil. Pediatría Integral
[Internet]. 2016 [Consultado el 27 de agosto de 2023];20(6):359-366. Disponible
en: https://www.pediatriaintegral.es/publicacion-2016-07/bases-geneticas-y-moleculares-en-el-cancer-infantil/
11. Campbell BM,
Ferreiro CM, Tordecilla CJ, Joannon
SP, Ri- zzardini LC,
Rodríguez ZN. Leucemia linfoblástica aguda.
Características al diagnóstico en 100 niños. Rev. chil.
pediatr. [Internet]. 1999 [Consultado el 5 de
setiembre de 2023];70(4):288-293. Disponible en: http://www.scielo.cl/scielo.php?script=sci_art
12. Lim JY, Bhatia S, Robison LL, Yang JJ. Genomics of
racial and ethnic disparities
in childhood acute lymphoblastic leukemia. Cancer. [Internet]. 2014 [Consultado el 5 de setiembre de
2023];120(7):955-62. doi: 10.1002/cncr.28531
13. Barrera Ramírez
LM, Drago Serrano ME, Pérez Ramos J, Sainz Espuñes
TR, Zamora Ana C, Gómez Arroyo F, et al. Citometría
de Flujo: Vínculo entre la investigación básica y la aplicación clínica. Rev.
Inst. Nal. Enf. Resp. Mex. [Internet]. 2004
[Consultado el 5 de setiembre de 2023];17(1):p.42-55.
Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-75852004000100007&lng=es
14. Marsán Suárez V, Sánchez Segura M, Socarrás
Ferrer BB, Martínez Machado M, Cos Padrón Y, del
Valle Pérez L, et al. Leucemia linfoide aguda común: Estudio del inmunofenotipo y las características clínicas y
morfológicas. Rev Cubana Hematol Inmunol Hemoter [Internet]. 2004 [Consultado el 13 de setiembre de 2023];20(2).
Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892004000200006&lng=es
15. Pui CH, Behm FG, Crist WM. Clinical and biologic relevance of immunologic marker studies in childhood acute lymphoblastic leukemia. Blood [Internet]. 1993
[Consultado el 13 de setiembre de 2023];82(2):343-62. Disponible en: https://pubmed.ncbi.nlm.nih.gov/8329694/
16. Al-Mawali A, Gillis D, Hissaria P, Lewis I. Incidence, sensitivity, and specificity of leukemia-associated phenotypes in
acute myeloid leukemia using specific five-color multiparameter flow cytometry. Am J Clin Pathol. [Internet]. 2008 [Consultado el 13 de setiembre de
2023];129(6):934-45. doi: 10.1309/FY0UMAMM91VPMR2W
17. Supriyadi E, Veerman AJ, Sutaryo, Purwanto I, Vd Ven PM, Cloos J. Myeloid-Antigen Expression in Childhood Acute Lymphoblastic Leukemia. New England Journal of Medicine
[Internet]. 1991 [Consultado el 17 de setiembre de 2023];325(19):1378-1382. https://doi.org/10.1056/NEJM199111073251914
18. Harrison CJ, Moorman AV, Broadfield ZJ, Cheung KL, Harris RL, Reza Jalali
G, et al. Three distinct subgroups of hypodiploidy in acute lymphoblastic leukaemia. British Journal of Haematology [Internet]. 2004 [Consultado el 17 de setiembre
de 2023];125:552-559. https://doi.org/10.1111/j.13652141.2004.04948.x
19. Dorantes-Acosta
E, Medina-Sanson A, Dávila-Ornelas K, Briceida López-Martínez B. Clasificación inmunológica de
las leucemias agudas linfoblásticas del Hospital
Infantil de México «Federico Gómez», de acuerdo al EGIL (European
Group for the Immunological Classification of Leukemia). Gac Mex Oncol.
[Internet]. 2013 [Consultado el 17 de setiembre de 2023];12(3):136-142.
Disponible en: https://www.elsevier.es/es-revista-gaceta-mexicana-oncologia-305-articulo-clasificacion-inmunologica-leucemias-agudas-linfoblasticas-X1665920113270088
20. Drexler HG, Thiel E, Ludwig WD. Review of the incidence
and clinical relevance of myeloid antigen-positive acute lymphoblastic leukemia. Leukemia [Internet].
1991 [Consultado el 17 de setiembre de 2023];5(8):637-645. https://pubmed.ncbi.nlm.nih.gov/1886419/
21. Béné MC, Nebe T, Bettelheim P, Buldini B, Bumbea H, et al. Immunophenotyping
of acute leukemia and lymphoproliferative disorders: a consensus proposal of the European LeukemiaNet
Work Package 10. Leukemia [Internet]. 2011 [Consultado el 24 de setiembre de
2023];25(4):567-574. doi: 10.1038/leu.2010.312
22. Ferlay J, Ervik M, Lam F, Laversanne M, Colombet M, Mery L,
Piñeros M, Znaor A, Soerjomataram
I, Bray F. Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on
Cancer [Internet]. 2024 [Consultado el 24 de
setiembre de 2023]. Disponible en: https://gco.iarc.who.int/today
23. Organización
Panamericana de la Salud. Cáncer [Internet]. 2024 [Consultado el 24 de
setiembre de 2023]. Disponible en: https://www.paho.org/es/temas/cancer
24. Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, Jemal
A. Global cancer statistics
2022: GLOBOCAN estimates of incidence
and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. [Internet]. 2024 [Consultado el 24 de setiembre de
2023];74(3):229-263. doi: 10.3322/caac.21834
25. Bhakta N, Force LM, Allemani C, Atun R, Bray F, Coleman MP, Steliarova-Foucher
E, Frazier AL, Robison LL, Rodri- guez-Galindo C, Fitzmaurice C. Childhood cancer burden: a review of global estimates. Lancet Oncol. [Internet]. 2019
[Consultado el 24 de setiembre de 2023];20(1):e42-e53.
doi: 10.1016/S1470-2045(18)30761-7
26. Organización
Mundial de la Salud. Cáncer. [Internet]. 2022 [Consultado el 27 de setiembre de
2023]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/cancer
27. Organización
Panamericana de la Salud, Organización Mundial de la Salud. Cáncer. [Internet].
2018 [Consultado el 27 de setiembre de 2023]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/cancer
28. Word Health Organization. The Global Cancer Observatory. [Internet]. 2021 [Consultado el 27 de
septiembre de 2023]. Disponible en: https://gco.iarc.fr/today/data/factsheets/populations/218-ecuador-fact-sheets.pdf
29. Word Health Organization-Ecuador. Number of new cases in 2020, both
sexes, all ages. The Global Cancer Observatory - All Rights Reserved
– March [Internet]. 2021 [Consultado el 27 de
septiembre de 2023]. Disponible en: https://co.iarc.fr/today/data/factsheets/populations/218-ecuador-fact-sheets.pdf
30. Groves FD, Linet MS, Devesa SS. Epidemiology of human leukemia. Curr Opin Hematol. [Internet]. 1994
[Consultado el 27 de setiembre de 2023];1(4):321-6. Disponible e: https://pubmed.ncbi.nlm.nih.gov/9371299/
31. Gold P, Freedman SO. Specific carcinoembryonic antigens of the human digestive system. J Exp Med.
[Internet]. 1965 [Consultado el 8 de octubre de 2023];122(3):467-81. doi: 10.1084/jem.122.3.467
32. Thomson DM, Krupey J, Freedman SO, Gold P. The radioimmunoassay of circulating carcinoembryonic antigen of the human digestive system. Proc Natl Acad.
[Internet]. 1969 [Consultado el 8 de octubre de 2023];64(1):161-7. doi: 10.1073/pnas.64.1.161
33. Kinugasa T, Kuroki M, Takeo H, Matsuo Y, Ohshima K, Yamashita Y, Shirakusa T, Matsuoka Y. Expression of four CEA family antigens (CEA, NCA, BGP
and CGM2) in normal and cancerous gastric
epithelial cells: up-regulation of BGP and CGM2 in carcinomas. Int J Cancer [Internet]. 1998
[Consultado el 8 de octubre de 2023];76(1):148-53. doi:
10.1002/(sici)1 097-0215(19980330)76:1<148:aid-ijc23>3.0.co;2-7
34. Organización
Mundial de la Salud. Cáncer. Notas Descriptivas. [Internet]. 2020 [Consultado
el 27 de setiembre de 2023]. Disponible en: http://www.who.int/mediacentre/factsheets/fs297/es/.
35. Marsán Suárez V, del Valle Pérez LO, Díaz Domínguez G,
Macías Abraham C, Machín García S, Lam Díaz RM, et al. Correlación entre
morfología y citometría de flujo en la Leucemia Linfoide
Aguda Infantil. Rev Cubana Hematol Inmunol Hemoter [Internet]. 2016 [ Consultado el 8 de octubre de
2023]; 32(4): 483-493. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892016000400007&lng=es
36. Martinez FF, Cervi L, Knubel CP, Panzetta-Dutari GM, Motran CC. The role of pregnancy-specific glycoprotein
1a (PSG1a) in regulating the
innate and adaptive immune response. Am J Reprod Immunol. [Internet]. 2013 [Consultado el 27 de setiembre de
2023];69(4):383-94. doi: 10.1111/aji.12089
37. Cruz RS,
Lancheros A, Márquez BY, et al. Caracterización biológica del marcador CD66c y
su importancia clínica en la leucemia linfoide aguda. Rev
Cubana Hematol Inmunol Hemoter. [Internet]. 2018
[Consultado el 27 de setiembre de 2023];34(3):1-12. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumenI.cgi?IDARTICULO=85866
38. Hrusák O, Porwit-MacDonald A. Antigen expression patterns reflecting genotype of acute leukemias. Leukemia [Internet].
2002 [Consultado el 27 de setiembre de 2023];16(7):1233-58. doi:
10.1038/sj.leu.2402504
39. Casado J,
Iñigo-Chaves A, Jiménez-Ruiz SM, Ríos-Arrabal S, Carazo-Gallego
Á, González-Puga C, et al. AA-NAT, MT1 and MT2 Correlates
with Cancer Stem-Like Cell Markers in Colorectal Cancer: Study of the Influence of Stage and p53 Status of Tumors. Int J Mol Sci. [Internet]. 2017
[Consultado el 27 de setiembre de 2023];18(6):1251. doi:
10.3390/ ijms18061251
40. Medical y Biological Laboratories.
Anti-CD66c (KOR- SA3544) (Human) mAb-FITC [Internet].
S/f [Consultado el 7 de octubre de 2023]. Disponible en: http://ruo.mbl.co.jp/bio/dtl/dtlfiles/D028-4-v4.pdf
41. Chan CH, Stanners CP. Recent advances in the tumour biology of the GPI-anchored carcinoembryonic antigen family members CEACAM5 and
CEACAM6. Curr Oncol.
[Internet]. 2007 [Consultado el 7 de octubre de 2023];14(2):70-3. doi: 10.3747/co.2007.109
42. Ismail, Zaghloul, Abdulateef. Morsi Membranous Expression of pan
CD66, CD66a, CD66b, and CD66c and their Clinical Impact in Acute Leukemia: Cross Sectional Longitudinal Cohort Study in Saudi Arabia. J Leuk. [Internet]. 2017 [Consultado el 7 de octubre de
2023];5(2):230-239. doi: 10.4172/2329-6917.1000230
43. Girnius N, Davis RJ. JNK Promotes
Epithelial Cell Anoikis by Transcriptional
and Post-translational Regulation
of BH3-Only Proteins. Cell
Rep. [Internet]. 2017 [Consultado el 7 de octubre de 2023];21(7):1910-1921. doi: 10.1016/j.celrep.2017.10.067
44. American Cancer Society. Detección
temprana, diagnóstico y tipos, Cancer Facts y Figures. Atlanta. [Internet]. [Consultado el 7 de
octubre de 2023]; Disponible en: https://www.cancer.org/content/dam/CRC/PDF/Public/8967.00.pdf
45. Maciel ALT, Barbosa
TDC, Blunck CB, Wolch K,
Machado AAL, et al. IKZF1 deletions associate with CRLF2 overexpression leading to a poor prognosis in B-cell precursor
acute lymphoblastic leukaemia. Transl Oncol. [Internet]. 2022 [Consultado el 7 de octubre de
2023];15(1):101291. doi: 10.1016/j.tranon.2021.101291
46. Russell LJ,
Jones L, Enshaei A, Tonin S,
Ryan SL, Eswaran J, et al. Characterisation of the genomic landscape of
CRLF2-rearranged acute lymphoblastic
leukemia. Genes Chromosomes
Cancer. [Internet]. 2017 [Consultado el 13 de octubre
de 2023];56(5):363-372. doi: 10.1002/gcc.22439
47. Coustan-Smith E, Sancho J, Hancock
ML, Boyett JM, Behm FG,
Raimondi SC, et al. Clinical importance
of minimal residual disease
in childhood acute lymphoblastic leukemia. Blood [Internet]. 2000 [Consultado el 13 de octubre de
2023];96(8):2691-6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/11023499/
Contribución de los autores
JXMB:
conceptualización, metodología, investigación y escritura (borrador original,
revisión y edición).
GDBO:
conceptualización, metodología, escritura (revi- sión y edición) y supervisión.
Fuentes de financiamiento
La
investigación fue realizada con recursos propios.
Conflictos de interes
Los autores declaran no tener conflictos de interés.
