Efecto antiinflamatorio in vitro
e in vivo de extractos de cuatro
especies del género Baccharis
In vitro and in vivo anti-inflammatory effect of extracts from four species of
the genus Baccharis
Jans Velarde Negrete 1,a
1. Universidad
Mayor de San Simón, Cochabamba, Bolivia.
a. Magister en Bioquímica Clínica y Microbiología.
ORCID: https://orcid.org/0000-0001-5664-9528
Zulema Bustamante Garcia 1,b
1. Universidad
Mayor de San Simón, Cochabamba, Bolivia.
b. Magister
en Bioquímica, Biología Celular y Molecular.
ORCID: https://orcid.org/0000-0003-2435-1406
Jenny Pinto Davalos 1,c
1. Universidad
Mayor de San Simón, Cochabamba, Bolivia.
c. Magister
en Ciencias Farmacéuticas.
ORCID: https://orcid.org/0009-0007-6181-551X
Silvia Zabalaga Vía 1,d
1. Universidad
Mayor de San Simón, Cochabamba, Bolivia.
d. Magister
en Farmacia Clínica y Farmacoterapia.
ORCID: https://orcid.org/0009-0007-7881-9998
Sandro Villarroel Franco 1,e
1. Universidad
Mayor de San Simón, Cochabamba, Bolivia.
e. Magister
en Bioquímica Clínica.
ORCID: https://orcid.org/0000-0002-8913-3891
Brian Axel Flores Merubia 1,f
1. Universidad
Mayor de San Simón, Cochabamba, Bolivia.
f. Licenciado
en Bioquímica y Farmacia.
ORCID: https://orcid.org/0009-0004-1650-1771
Citar
como: Velarde-Negrete
J, Bustamante-Garcia Z, Pinto-Davalos J, Zabalaga-Vía S, Villarroel-Franco S,
Flores-Merubia BA. Efecto antiinflamatorio in vitro e in vivo de extractos de cuatro especies del género Baccharis. Rev Perú Cienc Salud.
2025;7(3):#-#. doi: https://doi.org/10.37711/rpcs.2025.7.3.10
RESUMEN
Objetivo. Evaluar el efecto antiinflamatorio in
vitro e in vivo de extractos de
cuatro especies del género Baccharis.
Métodos. El estudio fue experimental
con enfoque cuantitativo. Las hojas del género Baccharis se recolectaron de las provincias Ayopaya y Chapare del Departamento de Cochabamba. Las especies B.
pentlandii, B. perulata, B. genistelloides y B. dracunculifolia se identificaron en el
Herbario Nacional Forestal “Martín Cárdenas”. De
cada especie se elaboraron extractos acuosos y etanólicos al 10 %. El
efecto antiinflamatorio in vitro se
determinó con el Kit de ensayo de detección de inhibidores de lipooxigenasa y fosfolipasa
A2 de Cayman; in vivo con el modelo de edema plantar inducido por carragenina
en 50 ratas macho Wistar. Se realizó un análisis descriptivo. Para determinar
la normalidad de datos se utilizó la prueba de Shapiro-Wilk y
Kolmogorov-Smirnov; para comparar los grupos analizados se empleó la prueba de
Kruskal-Wallis y ANOVA de una vía. Resultados.
El extracto acuoso de B. perulata inhibió
la lipooxigenasa un 91,9 %, mientras que el extracto acuoso de B. pentlandii
inhibió la fosfolipasa A2 un 81,2 %. Por otro lado, el extracto etanólico de B. dracunculifolia presentó mayor efecto
antiinflamatorio del volumen de edema plantar de ratas de un 90,7 %, con diferencias estadísticamente significativas
después de la primera hora (p <
0,05). Conclusiones.
Los extractos de Baccharis: B. perulata,
B. pentlandii y B. dracunculifolia tienen efecto
antiinflamatorio in vitro e in vivo superior a la indometacina, lo que respalda su uso como alternativa natural para
el tratamiento de la inflamación.
Palabras clave:
antiinflamatorio; Baccharis; edema; extractos; inhibidores de fosfolipasa A2;
lipooxigenasa (fuente: DeCS-BIREME).
ABSTRACT
Objective. To evaluate the in vitro and in vivo anti-inflammatory effect of extracts from four species of
the genus Baccharis. Methods. This was an experimental study
with a quantitative approach. Leaves of Baccharis
were collected from the provinces of Ayopaya and Chapare in the Department of
Cochabamba. The species B. pentlandii,
B. perulata, B. genistelloides, and B.
dracunculifolia were identified at the “Martín Cárdenas” National Forestry
Herbarium. Aqueous and ethanolic extracts (10 %) were prepared from each
species. The in vitro
anti-inflammatory effect was assessed using Cayman’s Lipoxygenase and
Phospholipase A2 Inhibitor Screening Assay Kits, while the in vivo effect was evaluated through the carrageenan-induced paw
edema model in 50 male Wistar rats. Descriptive analyses were conducted, with
data normality assessed using the Shapiro-Wilk and Kolmogorov-Smirnov tests,
and group comparisons performed through the Kruskal-Wallis test and one-way
ANOVA. Results. The aqueous extract
of B. perulata inhibited lipoxygenase
activity by 91,9 %, while the aqueous extract of B. pentlandii inhibited phospholipase A2 activity by 81,2 %. In contrast,
the ethanolic extract of B.
dracunculifolia exhibited the greatest anti-inflammatory effect on paw
edema volume in rats (90,7 %), with statistically significant differences after
the first hour (p < 0,05). Conclusions. Extracts of Baccharis (B. perulata, B. pentlandii,
and B. dracunculifolia) exhibited in vitro and in vivo anti-inflammatory effects superior to indomethacin,
supporting their potential as natural alternatives for inflammation treatment.
Keywords: anti-inflammatory; Baccharis; edema; extracts;
phospholipase A2 inhibitors; lipoxygenase (source: MeSH-NLM).
INTRODUCCIÓN
A nivel mundial, la inflamación
constituye un problema de salud pública importante (1), por estar
vinculada con un gran número de enfermedades autoinmunes (2-5) que
producen deterioro en la calidad de vida de la población y alta carga
socioeconómica (6). Para tratar la respuesta inflamatoria se emplean
antiinflamatorios no esteroideos (AINES) o esteroides (7,8). Sin
embargo, utilizarlos en dosis altas o por tiempo prolongado producen efectos
adversos gastrointestinales, renales, cardiovasculares, alteraciones
metabólicas, endocrinas, inmunitarias y del sistema nervioso (9,10).
Por ello, buscar terapias alternativas naturales con potencial
antiinflamatorio, inexistentes o menores efectos secundarios es fundamental.
Las plantas del género Baccharis, conformado por más de 350
especies distribuidas principalmente en Latinoamérica, poseen un amplio
reconocimiento en farmacognosia, gracias a los metabolitos secundarios, como
diterpenos, triterpenos y flavonoides (11). Investigaciones
internacionales realizadas en extractos de Baccharis
trimera (carqueja) demostraron
efectos antiinflamatorios e inmunomoduladores en modelos de pleuresía en ratas
e inhibición de mediadores inflamatorios in vitro (12), mientras que
extractos de Baccharis dracunculifolia (chilca blanca),
mostraron actividad antiinflamatoria en modelo de colitis ulcerativa en ratas (13).
Por otro lado, la gran
diversidad cultural y biológica existente en Bolivia se manifiesta en una
amplia gama de prácticas de medicina tradicional, siendo la más importante el
uso de plantas (14). Una alternativa antiinflamatoria es el género Baccharis, con casi 60 especies
identificadas en Bolivia, donde tradicionalmente son utilizadas en golpes,
torceduras y luxaciones por su efecto antiinflamatorio (15).
Estudios farmacológicos en extractos de estas especies indican que los
flavonoides identificados: 5,4-dihidroxi-6,7,8,3-tetrametoxiflavona,
8-metoxicirsilineol, 5,4-dihidroxi-6,7,8-trimetoxilavona y la sideritoflavona,
mostraron efecto antinflamatorio significativo contra la ciclooxigenasa (COX-1,
COX-2) y el factor de necrosis tumoral alfa (TNF-α) (16,17).
Con base en lo expuesto previamente, el
desarrollo de la presente investigación se justifica, dado que no se han
encontrado estudios que evalúen el efecto antiinflamatorio de Baccharis combinando modelos in vitro e in vivo. Así mismo, considerando el alto uso histórico y la amplia
biodiversidad en Bolivia, resulta necesario validar los efectos terapéuticos
atribuido a dichas especies con el fin de impulsar el desarrollo de terapias
alternativas y accesibles. Por consiguiente, el objetivo del estudio fue evaluar
el efecto antiinflamatorio in vitro e
in vivo de extractos de cuatro
especies del género Baccharis.
MÉTODOS
Tipo y área de estudio
El enfoque del
estudio fue cuantitativo, de tipo experimental, diseño transversal in vitro (la
inhibición de lipooxigenasa y fosfolipasa A2 fue realizada una sola vez) y
longitudinal in vivo (el volumen inflamado fue medido a lo largo del
tiempo), aleatorizado,
controlado, en grupos paralelos, desarrollado en
el Centro de Fármacos, Alimentos y Cosméticos (CEFAC), adscrita a la Facultad
de Ciencias Farmacéuticas y Bioquímicas de la Universidad Mayor de San Simón
(UMSS), ciudad de Cochabamba (Bolivia), durante los años 2023 y 2024.
Población y muestra
No fue posible establecer
la población de estudio; sin embargo, la muestra vegetal y animal de estudio
cumplieron los siguientes criterios:
a) Muestra
vegetal: fueron incluidas plantas de cuatro especies del género Baccharis, con hojas sanas y
recolectadas de municipios del Departamento de Cochabamba; en tanto que fueron
excluidas especies de Baccharis con
estudios previos en el CEFAC sobre efecto antiinflamatorio, con hojas dañadas y
contaminadas.
b) Muestra
animal: fueron incluidas 50 ratas macho Wistar (Rattus norvegicus albinus), de la misma especie, edad entre 3 a 4
meses, peso corporal entre
200 a 300 gramos y certificadas por una unidad de ensayos biológicos; mientras
que fueron excluidas ratas empleadas en un ensayo previo y que presentaran
alguna patología.
Variables e instrumentos de recolección de datos
Las variables del presente estudio fueron:
a) Inhibición
de lipooxigenasa (LO): fue determinada con el Kit de ensayo de detección de
inhibidores de LO ítem 760700 de Cayman (18), cuyas absorbancias
fueron leídas en un Stat Fax 303 Plus.
b) Inhibición
de fosfolipasa A2 (PLA2): Fue determinada con el Kit de ensayo de detección de
inhibidores de PLA2 ítem 10004883 de Cayman (19), sus absorbancias
fueron leídas en un Stat Fax 303 Plus.
c) Efecto
antiinflamatorio in vivo: fue
evaluado mediante el modelo de edema plantar inducido por carragenina y
descrito por Winter et al. (20); el volumen de inflamación a la 0,
1, 3, 5 y 7 horas fue medido con ayuda de un pletismómetro manual.
Los datos de las
variables “absorbancias”, “volumen de inflamación” y “porcentaje del efecto
antiinflamatorio” fueron recolectadas en un instrumento guía de observación.
Técnicas y procedimientos de la recolección de datos
Según, Valenzuela
(21), las especies del género Baccharis crecen todo el año y la
producción de hojas es mayor en meses húmedos; por ello, en el mes de febrero
las plantas de Baccharis dracunculifolia
(chilca blanca) fueron recolectadas del municipio de Independencia, en la
provincia de Ayopaya. Por su parte, en cambio, la Baccharis
pentlandii (chilca clara), Baccharis perulata (Yurak chilca) y Baccharis genistelloides (carqueja amarga) fueron recolectada en el
municipio de Colomi, en la provincia de Chapare del
Departamento de Cochabamba. Con una tijera de podar fueron cortados y
colocados los tallos en bolsas plásticas etiquetadas. De acuerdo con Arnelas et
al. (22), las especies del género Baccharis fueron identificadas en el Herbario
Nacional Forestal “Martín Cárdenas” (BOLV) de la Facultad de Ciencias y
Tecnología de la UMSS.
Las
hojas de cada especie del género Baccharis fueron
lavadas con abundante agua y desinfectadas con
hipoclorito de sodio a 80 ppm de concentración; luego, fueron secadas
artificialmente en una cámara de secado a 40 °C por 72 horas; después, fueron
trituradas en un mortero de porcelana. A continuación, de cada especie fueron
elaborados extractos acuosos y etanólicos al 10 %, los etanólicos fueron
macerados por 7 días y los acuosos 2 días; luego, fueron filtrados y
concentrados en un rotavapor hasta eliminar 3/4 partes del solvente y cada
extracto fue identificado y refrigerado entre 2-8 °C.
La detección de
inhibidores de la LO se realizó siguiendo las instrucciones dadas por el
fabricante en una microplaca por triplicado de la siguiente manera:
a) Blanco:
en los primeros tres pocillos se pipeteó 100 µl de buffer.
b) Estándar:
90 µl de LO + 10 µl de buffer.
c) 100 %
actividad inicial (AI): 90 µl de LO + 10 µl de metanol.
d) Inhibidores:
90 µl de LO + 10 μl de inhibidor (indometacina o extractos).
La placa fue
incubada durante cinco minutos a temperatura ambiente. La reacción se inició
añadiendo 10 µl de sustrato (ácido araquidónico) a cada pocillo.
Posteriormente, la placa fue colocada en un agitador durante diez minutos. La
catálisis enzimática fue detenida mediante la adición de 100 µl de cromógeno en
cada pocillo. Luego, la placa fue cubierta y agitada por cinco minutos.
Finalmente, fue retirada la cubierta y las absorbancias fueron medidas entre
490 y 500 nm en un Stat Fax 303 Plus.
Los inhibidores
de la PLA2 fueron detectados en una microplaca del siguiente modo:
a) Blanco:
en los primeros tres pocillos fueron pipoteados 10 µl de buffer + 10 µl de metanol.
b) Estándar:
10 µl de PLA2 + 10 µl de tioeteramida-PC.
c) 100 %
actividad inicial (AI): 10 µl de PLA2 + 10 µl de metanol.
d) Inhibidores:
10 µl de PLA2 + 10 μl de inhibidores (indometacina o extractos).
A continuación,
fueron añadidos 200 µl del sustrato (análogo de fosfatidilcolina) a todos los
pocillos; luego fueron agregados 10 µl de DTNB (ácido 5,5'-ditiobis-2-nitrobenzoico)
para iniciar la reacción. La placa fue agitada durante 10 segundos para mezclar
el contenido. Después, la placa fue cubierta e incubada por 15 minutos a 25 °C.
Por último, la cubierta fue retirada y las absorbancias fueron leídas entre 405
y 420 nm en un Stat Fax 303 Plus.
La concentración
y los grupos de inhibidores de la LO y PLA2 fueron los siguientes:
G1: Indometacina
100 µg/ml.
G2: extracto
acuoso de B. perulata (Yurak chilca)
100 µg/ml.
G3: extracto
etanólico de B. perulata (Yurak
chilca) 100 µg/ml.
G4: extracto
acuoso de B. pentlandii (chilca
clara) 100 µg/ml.
G5: extracto
etanólico de B. pentlandii (chilca
clara) 100 µg/ml.
G6: extracto
acuoso de B. genistelloides (carqueja
amarga) 100 µg/ml.
G7: extracto
etanólico de B. genistelloides
(carqueja amarga) 100 µg/ml.
G8: extracto
acuoso de B. dracunculifolia (chilca
blanca) 100 µg/ml.
G9: extracto
etanólico de B. dracunculifolia
(chilca blanca) 100 µg/ml.
Cálculos: primero, fue determinada la absorbancia promedio del blanco, 100 % AI y del inhibidor. Luego, al promedio de 100 % AI y del inhibidor se restó el promedio del blanco. El porcentaje de inhibición de LO y PLA2 se calculó con la siguiente fórmula:
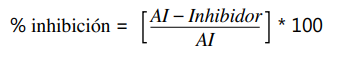
Para evaluar el
efecto antiinflamatorio in vivo, las ratas fueron
adquiridas de la Unidad de Ensayos Biológicos de la Facultad de Ciencias
Farmacéuticas y Bioquímicas, Universidad Mayor de San Andrés (UMSA), La Paz
(Bolivia), las
ratas fueron transportadas en cajas provistas por la Unidad de Ensayos
Biológicos y colocadas sobre el piso de un vehículo particular; en el trayecto
no se utilizó aire acondicionado ni calefacción, ya que no fue necesario.
Posterior a ello, fueron aclimatadas en el CEFAC por 7 días en grupos de cinco,
en jaulas metálicas bajo condiciones de temperatura de 22±3 °C, ciclos de
luz-oscuridad de 12 horas, cama de viruta cambiada cada 48 horas, alimento
balanceado en pellets y agua disponible ad
libitum, fueron sometidas a ayuno de 12 horas antes del ensayo con libre
acceso al agua; después, un personal independiente asignó aleatoriamente cinco
ratas a cada uno de los siguientes grupos:
G1: control
negativo.
G2: Indometacina
10 mg/kg de peso.
G3: extracto
acuoso B. perulata (Yurak chilca) 400
mg/kg de peso.
G4: extracto
etanólico B. perulata (Yurak chilca)
400 mg/kg de peso.
G5: extracto
acuoso B. pentlandii (chilca clara)
400 mg/kg de peso.
G6: extracto
etanólico B. pentlandii (chilca
clara) 400 mg/kg de peso.
G7: extracto
acuoso B. genistelloides (carqueja amarga)
400 mg/kg de peso.
G8: extracto
etanólico B. genistelloides (carqueja
amarga) 400 mg/kg de peso.
G9: extracto
acuoso B. dracunculifolia (chilca
blanca) 400 mg/kg de peso.
G10: extracto
etanólico B. dracunculifolia (chilca
blanca) 400 mg/kg de peso.
Primero, el
personal de análisis procedió a medir el volumen inicial de la pata trasera
derecha de la rata con un pletismómetro manual, según los estudios (23-25).
Luego, personal independiente administró un ml de tratamiento a los grupos
correspondiente por vía intraperitoneal; 30 minutos después, el edema fue
inducido mediante inyección subcutánea de 0,1 ml de carragenina al 1 % en la
aponeurosis plantar de la pata derecha de cada rata, de acuerdo con Amado et
al. (26). Posteriormente, se realizaron medidas del volumen a las 1,
3, 5 y 7 horas. El porcentaje de inhibición fue calculado con el volumen
promedio (x̄) del control y el (x̄) del tratamiento, con la siguiente fórmula:
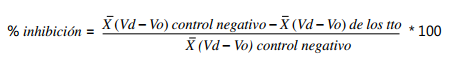
Vd: volumen luego
de aplicar carragenina. V0: volumen
antes de aplicar carragenina.
Análisis de datos
Aspectos éticos
Este estudio fue parte del proyecto de investigación “Aplicación
biotecnológica en la valorización de productos vegetales con fines productivos
y medicinales”, cuyo protocolo fue aprobado por el Comité de Bioética de la
Facultad de Medicina, UMSS, Cochabamba (Bolivia), de acuerdo con el código de
registro CE-25 emitido el 13 de enero de 2023. Se cumplieron todos los
principios éticos declarados por la Asociación Médica Mundial (AMM) sobre el
uso de animales en la investigación biomédica, reafirmada por la 203ª Sesión en
Buenos Aires, Argentina, en abril del 2016 (27).
RESULTADOS
La inhibición in vitro de LO por extractos de Baccharis a 100 µg/ml de concentración, demuestran que el extracto acuoso de B. perulata (yurak chilca) presentó un 91,9 % de inhibición mayor, en comparación al 85,6 % obtenido con indometacina, el 79,6 % con extracto acuoso de B. pentlandii (chilca clara), 75,9 % con extracto etanólico de B. pentlandii (chilca clara), el 72,2 % con extracto etanólico de B. genistelloides (carqueja amarga), el 69,1 % con extracto etanólico de B. perulata (yurak chilca), 66,1 % con extracto acuoso de B. genistelloides (carqueja amarga) y el 58,4 % con extracto acuoso de B. dracunculifolia (chilca blanca) (ver Figura 1).
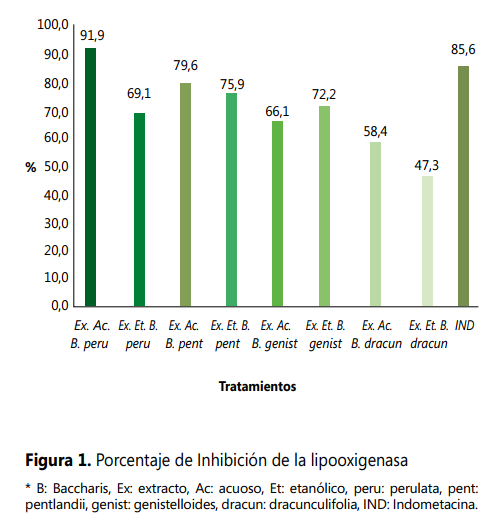
* B: Baccharis,
Ex: extracto, Ac: acuoso, Et: etanólico, peru: perulata, pent: pentlandii, genist: genistelloides, dracun: dracunculifolia, IND: Indometacina.
En relación con
la inhibición in vitro de la PLA2, el extracto acuoso de B. pentlandii (chilca clara), este presentó un 81,2 % de
inhibición; un porcentaje superior al 78,3 % del extracto acuoso de B. perulata (Yurak chilca), 67,8 % de la
indometacina y al resto de extractos de Baccharis,
los cuales presentaron porcentajes menores (ver Figura 2).
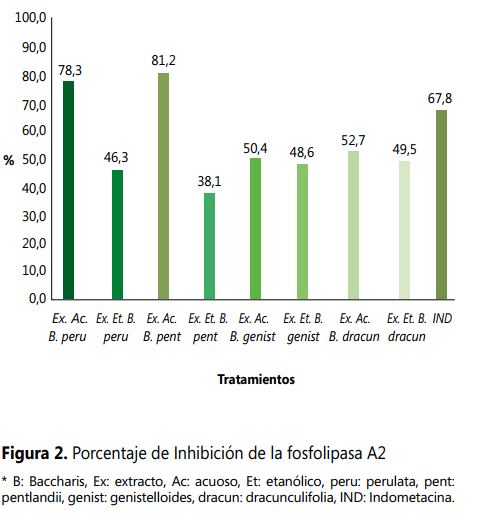
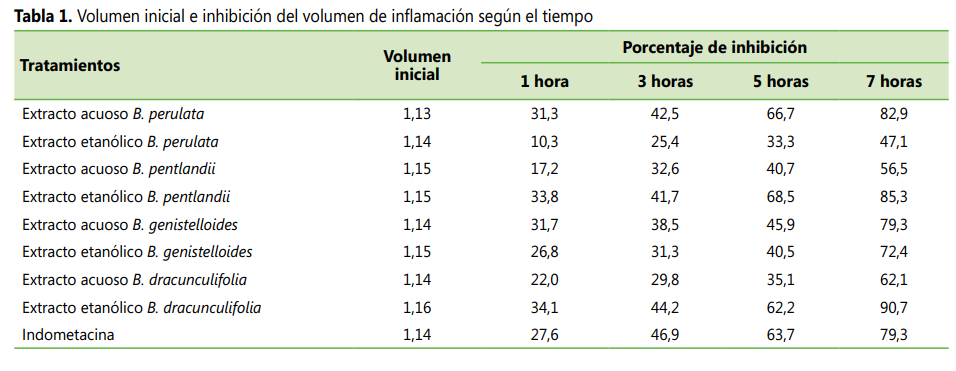
Acerca del porcentaje de inhibición del volumen
de inflamación a las 1, 3, 5 y 7 horas después de la administración de
carragenina el extracto etanólico de B.
dracunculifolia (chilca blanca), este presentó un 90,7 % de inhibición a
las 7 horas, seguido por el extracto etanólico de B. pentlandii (chilca
clara) con un 85,3 % y el extracto acuoso de B. perulata (Yurak chilca) con un 82,9 %; unos porcentajes mayores
al resto de extractos de Baccharis y
de la indometacina (ver Tabla 1).
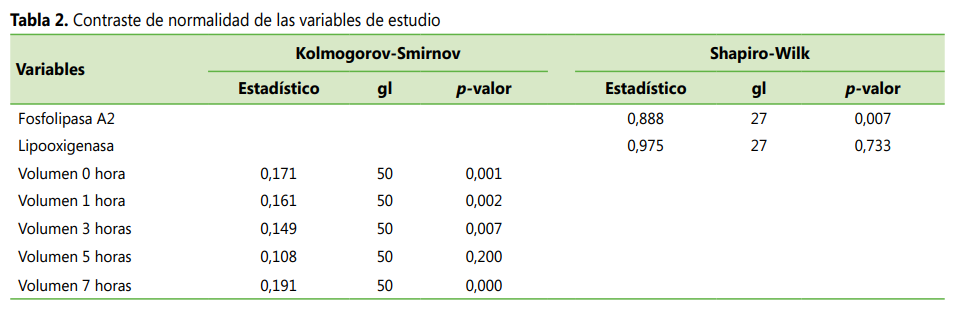
Los datos de absorbancias de inhibición de LO y el volumen de
inflamación a la quinta hora tenían distribución normal (p > 0,05), mientras que los datos de absorbancias de PLA2 y el
volumen de inflamación a la 0, 1, 3 y 7 horas no tuvieron distribución normal (p < 0,05) de la prueba de
Shapiro-Wilk y Kolmogorov-Smirnov (ver Tabla 2).
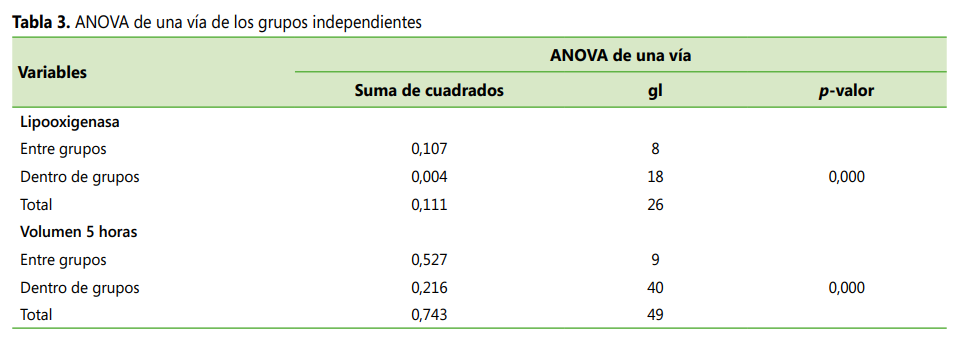
El análisis de
comparación de grupos independientes utilizando los tratamientos como factor
para datos con distribución normal refiere que existen diferencias estadísticas
significativas en las absorbancias de inhibición de la lipooxigenasa y del
volumen de inflamación a la quinta hora en al menos 2 grupos analizados según
el p < 0,05 del ANOVA de una vía
(ver Tabla 3).
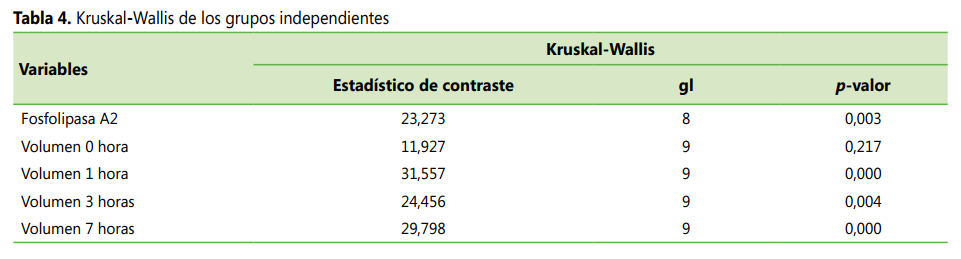
El análisis de comparación entre los grupos independientes para datos sin distribución normal refiere que no existen diferencias estadísticas significativas en el volumen de inflamación antes de administrar carragenina, mientras que en las absorbancias de inhibición de la fosfolipasa A2 y del volumen de inflamación a las 1, 3 y 7 hora existen diferencias estadísticas significativas en al menos 2 grupos analizados de acuerdo con el p < 0,05 de la prueba de Kruskal-Wallis (ver Tabla 4).
DISCUSIÓN
En el presente
estudio se evaluó el efecto antiinflamatorio de los extractos de cuatro
especies de Baccharis mediante
ensayos in vitro, como el de
inhibición de LO método de Sircar et al. (28), modificado por Evans
et al. (29), que emplea ácido araquidónico (AA) como sustrato;
mientras que la inhibición de PLA2 se realizó con el método de Reynolds et al. (30).
Por lo anterior, la inhibición in vitro
de la LO y PLA2 son modelos eficaces para identificar plantas con efecto
antiinflamatorio, ya que la lipooxigenasa vegetal es similar en varios aspectos
a la enzima que hidroliza el AA en animales (31). Además, se sabe
que varios metabolitos secundarios de origen natural son capaces de inhibir
estas enzimas (32). Por otro lado, el efecto antiinflamatorio in vivo se evaluó mediante edema
inducido por carragenina en la pata trasera de la rata, puesto que constituye
un buen modelo biológico ampliamente empleado en ensayos preclínicos para
evaluar fármacos antiinflamatorios (20).
En relación con
el porcentaje de inhibición in vitro
de la LO, en el estudio destacó el extracto acuoso de Baccharis perulata (yurak
chilca) con un porcentaje de inhibición superior al de la indometacina. Al
contrastar estos hallazgos con los de Abad et al. (33), se evidencia
que la inhibición de varios extractos fue del 100 %, en particular de los
diclorometánicos y hexánicos de Baccharis
pentlandii (chilca clara), B.
obtusifolia (chilca redonda), B.
subulata (suncho) y B. latifolia (chilca), diferencia que
podría deberse al solvente utilizado y especies de Baccharis analizadas. Por otra parte, en el estudio de Torres et
al. (34), los extractos etanólicos de B. boliviensis (chijua) y
B. tola (tola) a 200 µg/ml de concentración obtuvieron menor porcentaje de inhibición
in vitro de LO en contraste con los
de este trabajo, variación que puede atribuirse a una baja cantidad de
metabolitos secundarios capaces de inhibir esta enzima.
Los porcentajes de inhibición de la PLA2 de los extractos acuosos de B. pentlandii (chilca clara) y B. perulata (Yurak chilca) fueron
semejantes a los obtenidos de la mezcla de los ácidos oleanólico y ursólico,
aislados del extracto etanólico de B.
uncinella (vassoura) en el estudio de Zalewski et al. (35). Sin
embargo, fueron superiores a los porcentajes de inhibición de Torres et al. (34),
con extracto etanólico de B. boliviensis (chijua) y B.
tola (tola); la baja solubilidad de los compuestos presentes en estas
especies podría afectar la capacidad inhibitoria.
Los porcentajes de inhibición del volumen de inflamación a las 3, 5 y 7 horas, fueron
mayores para el extracto
etanólico de Baccharis dracunculifolia
(chilca blanca) y Baccharis pentlandii (chilca
clara) a 400 mg/kg de concentración; unos resultados idénticos a los reportados
por Dos Santos et al. (36) a las 3 horas con extracto
hidroalcohólico de B. dracunculifolia
(chilca blanca), a los de Pérez et al. (37) con extracto de Baccharis incarum (tola de río) y a los
de González et al. (38) con extracto de Baccharis latifolia (chilca), a las 5 horas. Por otro lado, fueron
menores en comparación con el 62 % obtenido a las 2 horas en el trabajo de
Rivera (39) con extracto etanólico de Baccharis buxifolia (tayanca), superando incluso al diclofenaco y
la dexametasona; esto podría deberse a que la especie de Baccharis fue diferente y el edema fue inducido con albúmina al 1
%.
El estudio presentó diferencias estadísticas significativas en la
inhibición in vitro de la LO y PLA2 en por lo menos dos grupos analizados; un
resultado contrario al de Torres et al. (34), sin diferencia significativa.
Los grupos analizados presentaron diferencias estadísticas significativas
de inhibición del volumen de inflamación utilizando los tratamientos
como factor, al igual que en las investigaciones desarrolladas por Dos Santos
et al. (36), Perez et al. (37), Gonzáles et al. (38)
y Rivera-Vicuña (39).
Una de las fortalezas del estudio fue el uso de modelos in vitro e in vivo que permiten identificar
plantas con efecto antiinflamatorio y evaluar fármacos antiinflamatorios. Otra fortaleza fue la inclusión de varias especies de Baccharis, lo que permite comparar los resultados etnofarmacológicos.
Una limitación del
estudio fue el no identificar y cuantificar los metabolitos secundarios
responsables del efecto antiinflamatorio; así también, el no evaluar posibles
efectos y toxicidad de los extractos, para futuras aplicaciones terapéuticas.
Se recomienda identificar y cuantificar los metabolitos secundarios
responsables del efecto antiinflamatorio. Así mismo, realizar estudios de
inflamación crónica y evaluar la toxicidad de los extractos.
Conclusiones
Los extractos acuosos y etanólicos de las especies Baccharis presentaron un efecto
antiinflamatorio significativo in vitro
e in vivo. El extracto acuoso de Baccharis perulata (yurak chilca) y
de Baccharis pentlandii (chilca clara) mostraron
mayor inhibición in vitro de LO y
PLA2, al superar a la indometacina. Por otro lado, el extracto etanólico de Baccharis dracunculifolia (chilca
blanca) presentó mayor efecto antiinflamatorio
del edema inducido por carragenina a las 1, 3, 5 y 7 horas.
EFERENCIAS BIBLIOGRÁFICAS
1. Salazar JÁ, Villanueva MA, García E, Soto GA. Actividad
antiinflamatoria in vitro de los extractos etanólico y hexánico de tallos de
Cuscuta jalapensis Schltdl. La granja [Internet]. 2018 [Consultado el 15 de
julio de 2025];26(75):20-27: Disponible en: https://biblat.unam.mx/hevila/InvestigacionycienciaUniversidadautonomadeaguascalientes/2018/no75/3.pdf
2. Noriega P, Idrobo T, Pintag M, Vinueza D, Larenas C. Actividad
antiinflamatoria in-vivo de una formulación tópica con principios activos de
aceites esenciales de Cannabis sativa L. (Cáñamo) y Baccharis latifolia (Ruiz
& Pav) Per. (Chilca). La Granja [Internet]. 2023 [Consultado el 14 de julio
de 2025];37(1):23-33. https://doi.org/10.17163/lgr.n37.2023.02
3. Rupani H, Fong WC, Kyyaly A,
Kurukulaaratchy R. Recent insights into the management of inflammation in
asthma. Journal of Inflammation Research [Internet]. 2021 [Consultado el 15 de
julio de 2025];14:4371-4397. https://doi.org/10.2147/JIR.S295038
4. Lochhead R, Strle K, Arvikar S, Weis, J,
Steere A. Lyme arthritis: linking infection, inflammation and autoimmunity. Nat Rev Rheumatol. [Internet]. 2021 [Consultado el 16 de julio de
2025];17(8):449-461. Disponible en: https://www.nature.com/articles/s41584-021-00648-5
5. Murata M. Inflammation and cancer. Environ
Health Prev Med [Internet]. 2018 [Consultado
el 16 de julio de 2025];23(50). https://doi.org/10.1186/s12199-018-0740-1
6. Rivera-Guilcapi MJ. Evaluación de la actividad antiinflamatoria
y citotóxica in vitro del extracto hidroalcohólico de hojas de Sigesbeckia
serrata DC. [Internet]. Ecuador: Escuela Superior Politécnica de Chimborazo;
2018 [Consultado el 15 de julio de 2025] Disponible en: https://dspace.espoch.edu.ec/handle/123456789/9558
7. García-Candela JLE, Pariona-Velarde CD, Londoñe-Bailon RB.
Actividad antiinflamatoria in vitro de los polisacáridos sulfatados de Patallus
mollis extraídos mediante digestión enzimática. Rev Peru Med Integrativa
[Internet]. 2017 [Consultado el 15 de julio de 2025];2(3):759-64. https://doi.org/10.26722/rpmi.2017.23.59
8. Acostupa FdM, Chávez A, Mejía SE, Pauta
MM, Tucunango JL. Efecto antinflamatorio in
vitro de los extractos etanólicos de cuatro plantas medicinales peruanas. Rev
Peru Med Integrativa [Internet]. 2017 [Consultado el 15 de julio de
2025];2(2):79-85. https://doi.org/10.26722/rpmi.2017.22.48
9. Rodríguez-González M, Espinosa-Rosales F. Uso de
glucocorticoides sistémicos en Pediatría: generalidades. Acta Pediatr Mex.
[Internet]. 2016 [Consultado el 15 de julio de 2025];37(6):349-354. https://doi.org/10.18233/APM37No6pp349-354
10. Maldonado DA, Segovia LC, Fuel ED, Naranjo A, Zurita GC, Melo LO,
et al. Efectos adversos de los fármacos antiinflamatorios no esteroideos:
artículo de revisión. Latam [Internet]. 2024 [Consultado el 15 de julio de
2025];5(1):1735-1749. https://doi.org/10.56712/latam.v5i1.1706
11. Rosero S, Del Pozo F, Simbaña W, Álvarez M, Quinteros M, Carrillo
W, et al. Polyphenols and
flavonoids composition, anti-inflammatory and antioxidant. properties of Andean
Baccharis macrantha extracts. Plants
[Internet]. 2022 [Consultado el 16 de julio de 2025];11(12):1555. https://doi.org/10.3390/plants11121555
12. Paul EL, Lunardelli A, Caberlon E, de
Oliveira CB, Santos RC, Biolchi V. et al. Anti-inflammatory and
immunomodulatory effects of Baccharis trimera aqueous extract on induced
pleurisy in rats and lymphoproliferation in vitro. Inflammation [Internet]. 2009 [Consultado el 16 de julio de
2025];32(6):419-425. https://doi.org/10.1007/s10753-009-9151-1
13. Cestari SH, Bastos JK, Di Stasi LC. Intestinal Anti‐Inflammatory Activity of Baccharis
dracunculifolia in the Trinitrobenzenesulphonic Acid Model of Rat Colitis.
Evidence‐Based Complementary and
Alternative Medicine [Internet]. 2011 [Consultado el 16 de julio de
2025];2011(1):524349. https://doi.org/10.1093/ecam/nep081
14. Peredo-Lazarte A, Pinto-Rios CR. Conocimiento y utilización de plantas medicinales en comunidades yuracares.
TIPNIS, Cochabamba, Bolivia. Gac Med Bol. [Internet]. 2020 [Consultado el 16 de
julio de 2025];43(1):41-48: Disponible en: https://www.gacetamedicaboliviana.com/index.php/gmb/article/view/84
15. Gonzales E, Villca T, Loza R. Evaluación de la actividad antiinflamatoria
de ocho especies del género baccharis: b. articulata, b. dracunculifolia, b.
salicifolia, b. ulcina, b. latifolia, b. pentlandii, b. obtusifolia, b.
subalata. Rev. Bol. Quim. [Internet]. 2007 [Consultado el 16 de julio de
2025];24(1):41-44: Disponible en: http://www.revistasbolivianas.ciencia.bo/pdf/rbq/v24n1/v24n1a08.pdf
16. Tarqui S, Flores Y, Almanza R.
Polyoxygenated flavonoids from Baccharis pentlandii. Revista Boliviana de Química [Internet]. 2012 [Consultado el 16 de julio
de 2025];29(1):10-14: Disponible en: http://www.scielo.org.bo/pdf/rbq/v29n1/v29n1a02.pdf
17. Sotillo WS, Tarqui S, Huang X, Almanza G,
Oredsson S. Breast cancer cell line toxicity of a flavonoid isolated from
Baccharis densiflora. Complementary
Medicine and Therapies [Internet]. 2021 [Consultado el 16 de julio de
2025];21(188):1-11. https://doi.org/10.1186/s12906-021-03349-4
18. Cayman Chemical. Lipoxygenase Inhibitor
Screening Assay Kit Item N.º 760700 [Internet]. Ann Arbor, Michigan 48108 USA; 10 de abril de 2017 [Consultado el 16 de
julio de 2025]. Disponible en: https://cdn.caymanchem.com/cdn/seawolf/insert/760700.pdf
19. Cayman Chemical. sPLA2 (Type V) Inhibitor
Screening Assay Kit Item N.º 10004883 [Internet]. Ann Arbor, Michigan 48108 USA; 05 de mayo de 2017 [Consultado el 16 de
julio de 2025]. Disponible en: https://cdn.caymanchem.com/cdn/seawolf/insert/10004883.pdf
20. Winter CA, Risley EA, Nuss GW. Carrageenin-induced edema in hind paw of the rat as an assay for
antiinflammatory drugs. Proc Soc Exp Biol
Med. [Internet]. 1962 [Consultado el 16 de julio de 2025];111(3):544-547:
Disponible en: https://journals.sagepub.com/doi/abs/10.3181/00379727-111-27849
21. Valenzuela E. La chilka en el valle de La Paz. Rev Cien Cult
[Internet]. 2023 [Consultado el 10 de julio de 2025];27(51):63-88: Disponible
en: http://www.scielo.org.bo/pdf/rcc/v27n51/2077-3323-rcc-27-51-63.pdf
22. Arnelas I, Invernón VR, de la Estrella M, López E, Devesa JA.
Manual de laboratorio de Botánica. El herbario. Recolección, procesamiento e
identificación de plantas vasculares. Reduca (Biología). Serie Botánica
[Internet]. 2012 [Consultado el 10 de julio de 2025];5(2):15-24 Disponible en: https://www.uco.es/organiza/departamentos/botanica/images/documentos/material-docente/manual-herbario.pdf
23. Villena CA, Arroyo JL. Efecto antiinflamatorio del extracto
hidroalcohólico de Oenothera rosea (yawar socco) en ratas con inducción a la
inflamación aguda y crónica. Ciencia e investigación [Internet]. 2012
[Consultado el 17 de julio de 2025];15(1):15-19: Disponible en: https://sisbib.unmsm.edu.pe/bvrevistas/ciencia/v15_n1/pdf/a03v15n1.pdf
24. Curinambe-Torres WL, Zelada-Sánchez IO. Efecto antiinflamatorio del extracto hidroalcohólico de las hojas de
cestrum auriculatum heritier “hierba santa” en ratas con inducción a
inflamación [Internet]. Lima: Universidad Inca Garcilaso de la Vega; 2018
[Consultado el 17 de julio de 2025] Disponible en: https://core.ac.uk/download/pdf/230576463.pdf
25. Delgado-Rodriguez GG, Kana-Mamani LF. Actividad antiinflamatoria
in vivo del gel a base del extracto hidroalcohólico de la raíz de krameria
lappacea (Ratania) en animales de experimentación [Internet]. Lima: Universidad
María Auxiliadora; 2023 [Consultado el 17 de julio de 2025] Disponible en: https://repositorio.uma.edu.pe/handle/20.500.12970/1423
26. Amado-Cornejo ND, Atusparia-Flores G, Huamán-Cabrera MV,
Méndez-Pajares Á, Prado-Asencios E, Jurupe-Chico H, et al. Actividad
antiinflamatoria del extracto etanólico de las hojas de Manihot esculenta
Crantz (yuca) en un modelo experimental de inflamación aguda. Rev. Fac. Med.
Hum. [Internet]. 2020 [Consultado el 17 de julio de 2025];20(1):94-98:
Disponible en: http://www.scielo.org.pe/scielo.php?pid=S2308-05312020000100094&script=sci_arttext
27. Asociación Médica Mundial. Declaración de la AMM sobre el uso de
animales en la investigación biomédica (adoptada por la 41.ª Asamblea Médica
Mundial, Hong Kong, setiembre 1989, revisada por la 57.ª Asamblea General de la
AMM, Pilanesberg, Sudáfrica, octubre 2006 [Internet]. Buenos Aires: AMM; 2016
[Consultado el 17 de julio de 2025]. Disponible en: https://www.wma.net/es/policies-post/declaracion-de-la-amm-sobre-el-uso-de-animales-en-la-investigacion-biomedica/
28. Sircar JC, Schwender CF, Johnson EA. Soybean
lipoxygenase inhibition by nonsteroidal antiinflammatory drugs. Prostaglandins
[Internet]. 1983 [Consultado el 16 de julio de 2025];25(3):393-396. https://doi.org/10.1016/0090-6980(83)90042-4
29. Evans AT, Formukong EA, Evans FJ. Actions of
cannabis constituents on enzymes of arachidonate metabolism: anti-inflammatory
potential. Biochem. Pharmac. [Internet]. 1987 [Consultado
el 16 de julio de 2025];36(12):2035-2037. https://doi.org/10.1016/0006-2952(87)90505-3
30. Reynolds LJ, Hughes LL, Dennis EA. Analysis
of human synovial fluid phospholipase A2 on short chain
phosphatidylcholine-mixed micelles: development of a spectrophotometric assay
suitable for a microtiterplate reader. Analytical biochemistry [Internet]. 1992 [Consultado el 16 de julio de
2025];204(1):190-197. https://doi.org/10.1016/0003-2697(92)90160-9
31. Gardner HW. Recent investigations into the
lipoxygenase pathway of plants. Biochimica et
Biophysica Acta [Internet]. 1991 [Consultado el 16 de julio de
2025];1084(3):221-239. https://doi.org/10.1016/0005-2760(91)90063-N
32. Barrera-Luna G, Cazar ME. Inhibición de enzimas fosfolipasas A2
de venenos totales de serpientes como estrategia en la búsqueda de nuevos
fármacos. Rev. Cs. Farm. y Bioq. [Internet]. 2023 [Consultado el 16 de julio de
2025];11(1):37-53: Disponible en: http://www.scielo.org.bo/pdf/rcfb/v11n1/2310-0265-rcfb-11-01-37.pdf
33. Abad MJ, Bessa AL, Ballarin B, Aragón O,
Gonzales E, Bermejo P. Anti-inflammatory activity of four Bolivian Baccharis
species (Compositae). Journal of
ethnopharmacology [Internet]. 2006 [Consultado el 16 de julio de
2025];103(3):338-344. https://doi.org/10.1016/j.jep.2005.08.024
34. Torres-Carro R, Alberto MR. Evaluación del potencial antiinflamatorio de especies vegetales que
habitan en zonas extremas del noroeste argentino [Internet]. Tucumán:
Universidad Nacional de Tucumán; 2018 [Consultado el 15 de julio de 2025]
Disponible en: https://ri.conicet.gov.ar/handle/11336/102861
35. Zalewski CA, Passero LFD, Melo AS, Corbett
CEP, Laurenti M, Toyama MH, et al. Evaluation of anti-inflammatory activity of
derivatives from aerial parts of Baccharis uncinella. Pharmaceutical biology [Internet]. 2011 [Consultado el 16 de julio de
2025];49(6):602-607. https://doi.org/10.3109/13880209.2010.537828
36. Dos Santos DA, Fukui MDJ, Nanayakkara ND, Khan SI, Sousa JPB,
Bastos JK, et al. Anti-inflammatory and antinociceptive effects of Baccharis
dracunculifolia DC (Asteraceae) in different experimental models. Journal of Ethnopharmacology [Internet]. 2010
[Consultado el 18 de julio de 2025];127(2):543-550. https://doi.org/10.1016/j.jep.2009.09.061
37. Perez F, Marin E, Adzet T. The
antiinflammatory effect of several composite from South America. Extracts in rats. Phytotherapy Research [Internet]. 1995 [Consultado el
17 de julio de 2025];9(2):145-146. https://doi.org/10.1002/ptr.2650090214
38. González MC, Ospina LF, Calle J, Rincón J. Evaluación de
extractos y fracciones de plantas colombianas en modelos de inflamación aguda,
subcrónica y crónica. Rev. colomb. cienc. quim. farm. [Internet]. 2007
[Consultado el 17 de julio de 2025];36(2):166-174: Disponible en: http://www.scielo.org.co/pdf/rccqf/v36n2/v36n2a05.pdf
39. Rivera-Vicuña DW. Actividad antiinflamatoria del extracto
etanólico de las hojas del Baccharis buxifolia (Lam.) Pers. “Talla” en ratones
[Internet]. Lima: Universidad Privada Norbert Wiener; 2018 [Consultado el 17 de
julio de 2025] Disponible en: https://hdl.handle.net/20.500.13053/2143
Contribución de los autores
JVN: metodología,
análisis formal, investigación, adquisición de fondos, supervisión, redacción y
revisión final del artículo.
ZBG:
conceptualización, metodología y revisión final del artículo.
JPD:
administración del proyecto, validación y revisión final del artículo.
SZV:
administración del proyecto, validación y revisión final del artículo.
SVF:
investigación, curación de datos, recursos y revisión final del artículo.
BAFM: recursos,
investigación y revisión final del artículo.
Fuentes
de financiamiento
El presente
estudio fue financiado por la Universidad Mayor de San Simón (UMSS), mediante
resolución del Honorable Consejo Universitario (RCU) N.º 102/23.
Conflictos de interés
Los autores
declaran no tener conflictos de interés.
Correspondencia
Correo electrónico ja.velarde@umss.edu.bo

