
Artículo
original cuantitativo
Evaluación de
pruebas serológicas comerciales para el diagnóstico de la enfermedad de Chagas
Evaluation of commercial serological tests for the
diagnosis of Chagas disease
Moria Villca-Chuquichambi 1, a
- Universidad Adventista de Bolivia, Cochabamba,
Bolivia.
- Magister en Microbiología Clínica.
ORCID: http://orcid.org/0000-0002-9159-9711
CORREO: moria.villca@uab.edu.bo
Fuentes de
financiamiento
La investigación
fue autofinanciada.
Conflictos de
interés
Los autores
declaran no tener conflictos de interés.
Citar como: Villca-Chuquichambi, M. Evaluación de pruebas
serológicas comerciales para el diagnóstico de la enfermedad de Chagas. Rev Perú Cienc Salud. 2025;7(2):145-50.
doi: https://doi.org/10.37711/rpcs.2025.7.2.11
RESUMEN
Objetivo.
Evaluar las pruebas serológicas comerciales para el diagnóstico de la
enfermedad de Chagas, determinando la sensibilidad, especificidad de
hemaglutinación indirecta (HAI), del Chagas POLYCHACO (Argentina) y del test
ELISA para Chagas III® (Laboratorios BiosChile),
utilizando como prueba de referencia el Chagatest
ELISA recombinante v.3.0 (Laboratorios Wiener). Métodos. Se analizaron
105 sueros positivos y 40 negativos para la enfermedad de Chagas. Adicionalmente,
se incluyeron 2 sueros de pacientes con leishmaniasis
y 2 sueros con pacientes con toxoplasmosis. Los sueros fueron analizados
mediante hemaglutinación indirecta mediante, el test ELISA Chagas III y el Chagatest ELISA recombinante v.3.0. Resultados. La
prueba de hemaglutinación indirecta presentó una sensibilidad del 100 % y una
especificidad del 55,56 %, mientras que el test ELISA para Chagas III mostró
una sensibilidad del 86,30 % y una especificidad del 98,61 %. La concordancia
entre las pruebas fue moderada y muy buena (coeficiente Kappa: 0,56-0,85). Se
observó reacciones cruzadas con sueros de pacientes con leishmaniasis
y toxoplasmosis en los test ELISA. Conclusiones. Las pruebas serológicas
comerciales evaluados mostraron una sensibilidad y especificidad variable y se
observó una concordancia moderada y muy buena entre las pruebas.
Palabras claves:
enfermedad de Chagas; pruebas de ELISA; hemaglutinación indirecta; pruebas de
diagnóstico; Trypanosoma cruzi;
sensibilidad y especificidad (fuente: DeCS-BIREME).
ABSTRACT
Objective. To evaluate commercial serological tests for the
diagnosis of Chagas disease by determining the sensitivity and specificity of
indirect hemagglutination (IHA), the Chagas POLYCHACO
test (Argentina), and the ELISA Chagas III® test (Laboratorios
BiosChile), using the Chagatest
ELISA recombinant v.3.0 (Laboratorios Wiener) as the
reference standard. Methods. A total of 105 positive and 40 negative
serum samples for Chagas disease were analyzed. Additionally, two serum samples
from patients with leishmaniasis and two from
patients with toxoplasmosis were included. All samples were tested using
indirect hemagglutination, the ELISA Chagas III test,
and the Chagatest ELISA recombinant v.3.0. Results.
The indirect hemagglutination test showed 100%
sensitivity and 55.56 % specificity, while the ELISA Chagas III test
demonstrated 86.30 % sensitivity and 98.61 % specificity. Agreement between
tests ranged from moderate to very good (Kappa coefficient: 0.56-0.85).
Cross-reactivity was observed in the ELISA tests with sera from patients with leishmaniasis and toxoplasmosis. Conclusions. The
evaluated commercial serological tests showed variable sensitivity and
specificity, with moderate to very good concordance between them.
Keywords: Chagas disease;
ELISA tests; indirect hemagglutination; diagnostic
tests; Trypanosoma cruzi;
sensitivity and specificity (source: MeSH-NLM).
INTRODUCCIÓN
La enfermedad de
Chagas es una patología parasitaria originada por el hematozoario Trypanosoma cruzi (T.
cruzi), un parásito flagelado cuyo ciclo de vida
alterna entre un insecto triatomino y un huésped
mamífero, que incluye al ser humano (1-3).
Se estima que,
para el año 2025, más de siete millones de personas en todo el mundo están
infectadas por T. cruzi, lo que provoca
unas 10 000 muertes al año (4). Esta enfermedad se encuentra
predominantemente en zonas endémicas de 21 países de América Latina, donde la
transmisión principal ocurre a través de la picadura de triatominos
infectados (transmisión vectorial) (5). Sin embargo,
existen también otras formas de transmisión no vectorial, como la transplacentaria, las transfusiones sanguíneas, los
trasplantes de órganos, el consumo de alimentos contaminados y los accidentes
en entornos de laboratorio (6,7).
En Bolivia, a
pesar de las estrategias implementadas para controlar la enfermedad de Chagas,
sigue siendo una de las principales causas de afecciones crónicas que afectan
al corazón y el sistema digestivo, por lo que la detección oportuna es
fundamental para prevenir complicaciones graves y mejorar la calidad de vida de
los pacientes (8,9). Para diagnosticar la enfermedad, se
emplean comúnmente pruebas serológicas comerciales que detectan anticuerpos
específicos contra el parásito en la sangre, siendo útiles en la fase crónica
de la enfermedad (10,11).
Diversos
estudios han evaluado y comparado las pruebas serológicas comerciales para el
diagnóstico de la enfermedad de Chagas. En uno de ellos, ELISA IgG+IgM®, realizado por Viettri
et al. (12), se reportó una sensibilidad del 93,4
%. Por su parte, el Speed Oligo
Chagas® mostró una sensibilidad del 92,6 % y una especificidad del 100 %. En
otro estudio de Kelly et al. (13), las pruebas Wiener Lisado, Wiener
v.4.0 y Abbott PRISM demostraron sensibilidades del 97,1 % y una especificidad
del 100 %. Así mismo, en un estudio de Whitman et al.
(14) se observaron variaciones en la sensibilidad y especificidad
entre diferentes pruebas.
Las pruebas
serológicas más comunes son la inmunofluorescencia
indirecta (IFI), la hemaglutinación indirecta (HAI) y el inmunoensayo
enzimático (ELISA). Sin embargo, estas pruebas presentan diferencias
significativas en sensibilidad y especificidad, las cuales pueden depender de
factores como la ubicación geográfica, el antígeno utilizado y las
características de la población estudiada (15-17). En este contexto,
el objetivo de este estudio fue evaluar las pruebas serológicas comerciales
para el diagnóstico de la enfermedad de Chagas, determinando la sensibilidad y
especificidad de la hemaglutinación indirecta (HAI) Chagas POLYCHACO
(Argentina) y del test ELISA para Chagas III® (Laboratorios BiosChile), utilizando como prueba de referencia el Chagatest ELISA recombinante v.3.0 (Laboratorios Wiener).
MÉTODOS
Tipo y área de
estudio
Se realizó un
estudio de enfoque cuantitativo, de tipo comparativo, observacional y de corte
transversal en el laboratorio OMEGALAB, ubicado en la ciudad de Cochabamba, en
Bolivia, durante el periodo de enero a mayo de 2024.
Población y
muestra
La población muestral de estudio estuvo constituida por 145 muestras de
sueros obtenidos de pacientes sospechosos de enfermedad de Chagas. De estos,
105 sueros fueron positivos y 40 negativos. Así mismo, se incluyeron 2
controles positivos y 2 controles negativos. Para evaluar posibles reacciones
cruzadas, se incluyeron 2 sueros de pacientes toxoplasmosis y 2 sueros de
pacientes con leishmaniasis. Las muestras fueron
seleccionadas mediante un muestreo no probabilístico por conveniencia, el cual
se eligió debido a la disponibilidad y calidad de los sueros en el contexto de
la investigación.
Técnicas e
instrumentos de recolección de datos
Los sueros
fueron analizados mediante las pruebas serológicas comerciales: el kit HAI
Chagas POLYCHACO (Argentina) (18), ELISA para Chagas III®,
desarrollado por Laboratorios BiosChile (Chile) (19)
y Chagatest ELISA recombinante v.3.0, desarrollado
por Laboratorios Wiener (Argentina) (20); este último fue utilizado
como prueba de referencia.
El procesamiento
de todas las muestras y sueros de control se realizó de acuerdo con las
instrucciones proporcionadas por los fabricantes de los kits, y los resultados
fueron registrados en un cuaderno de resultados, incluyendo todas las variables
requeridas para el estudio, como la sensibilidad, especificidad y concordancia
entre las pruebas.
Análisis de
datos
Los datos
obtenidos fueron organizados en una base de datos en Excel y analizados con el software
SPSS Statistics v.23. Se construyeron tablas de contingencia
2x2 para calcular la sensibilidad y especificidad de las pruebas serológicas
comerciales. La correlación entre los métodos se determinó mediante la prueba
de chi-cuadrado de Pearson, considerando valores de p
< 0,05 como estadísticamente significativos. La concordancia entre los
métodos fue evaluada utilizando el índice Kappa de Cohen, interpretado según
los criterios de Landis y Koch: pobre (< 0,40),
moderada (0,41-0,60), buena (0,61-0,80) y muy buena (0,81-1,0).
Aspectos éticos
El estudio se llevó
a cabo siguiendo los lineamientos éticos establecidos en la Declaración de
Helsinki. Los participantes otorgaron su consentimiento informado de forma
voluntaria, garantizando la confidencialidad de sus datos, los cuales fueron
utilizados exclusivamente con fines científicos.
RESULTADOS
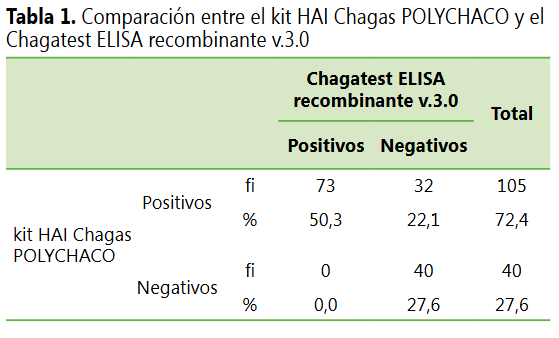
De un total de
145 muestras analizadas, la prueba del kit HAI Chagas POLYCHACO detectó 105
positivos y 40 negativos, mientras que el Chagatest
ELISA recombinante v.3.0 detectó 73 positivos y 72 negativos (ver Tabla 1).
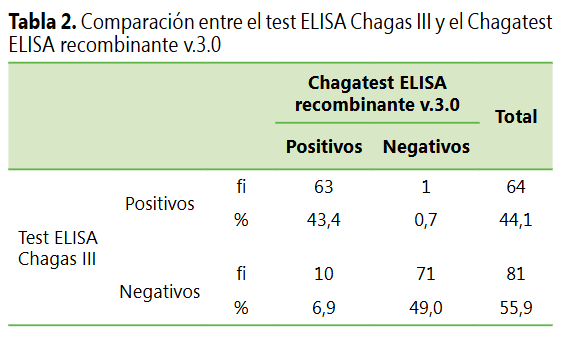
Por otro lado,
de un total de 145 muestras analizadas, el test ELISA Chagas III detectó 64
positivos y 81 negativos, mientras que el Chagatest
ELISA recombinante v.3.0 detectó 73 positivos y 72 negativos (ver Tabla 2).
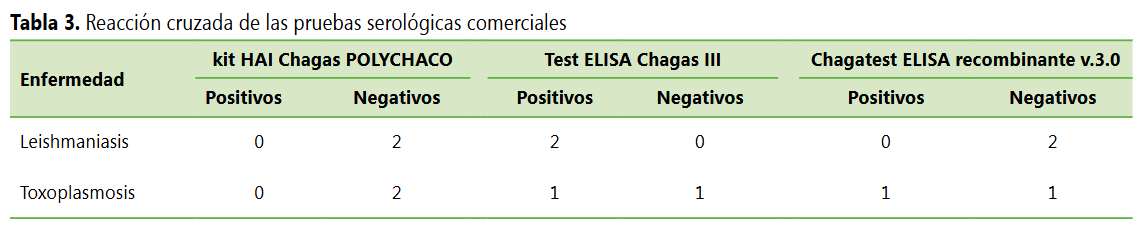
En cuanto
a la reacción cruzada, de un total de 2 sueros de toxoplamsosis
y 2 de leishmaniasis se observó reacción cruzada en 2
sueros de leishmaniasis y 1 suero de toxoplasmosis
con el test ELISA Chagas III, mientras que con el Chagatest
ELISA recombinante v.3.0 se detectó reacción cruzada en 1 suero de
toxoplasmosis (ver Tabla 3).
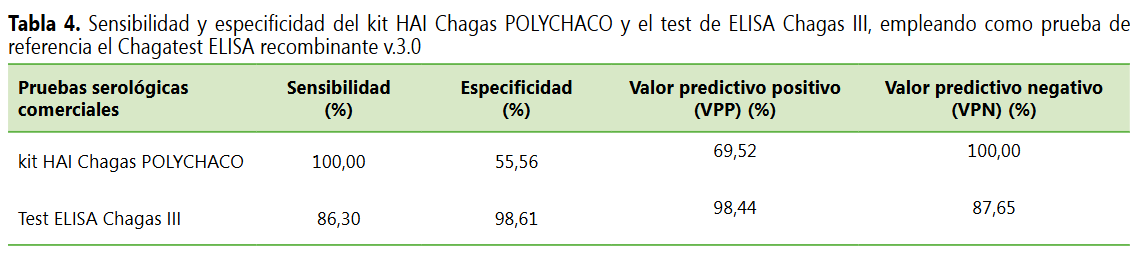
Por otra parte,
el kit HAI presentó 100 % de sensibilidad y una especificidad del 55,56 %. Por
su parte, el test ELISA Chagas III mostró una sensibilidad del 86,30 % y una
especificidad del 98,51 % (ver Tabla 4).
La concordancia
entre el kit HAI Chagas POLYCHACO y el Chagatest
ELISA recombinante v.3.0 fue de 0,56, con un intervalo de confianza (IC) del 95
%, lo que indica una concordancia moderada entre ambas pruebas. Por otro lado,
la concordancia entre el test ELISA Chagas III y el Chagatest
ELISA recombinante v.3.0 fue de 0,85, con un IC del 95 %, lo que representa una
concordancia muy buena entre ambas pruebas. El análisis de chi-cuadrado
de Pearson mostró un valor de p = 0,000 (p < 0,05 a un
intervalo de confianza de 95 %), lo que indica una relación significativa entre
la prueba del kit HAI Chagas POLYCHACO, el test ELISA Chagas III y el Chagatest ELISA recombinante v.3.0 (ver Tabla 5).

DISCUSIÓN
En este estudio
se observó una discrepancia entre los resultados de las diferentes pruebas
serológicas. La prueba de HAI Chagas POLYCHACO detectó 105 casos positivos y 40
negativos, mientras que el test ELISA Chagas III detectó 64 positivos y 81
negativos, y, por su parte, el Chagatest ELISA
recombinante v.3.0 identificó 73 positivos y 72 negativos. Estas diferencias
reflejan que, aunque son útiles, las pruebas serológicas presentan distintas
capacidades de detección.
Si bien estas
pruebas serológicas suelen tener alta sensibilidad, su especificidad puede
verse afectada por reacciones cruzadas con parásitos como Leishmania
spp., T. rangeli, Plasmodium spp. y T. gondii (21). En este estudio se observaron
reacciones cruzadas con sueros de pacientes con leishmaniasis
y toxoplasmosis. La presencia de estas coinfecciones
puede afectar la precisión de las pruebas serológicas, lo que puede producir
diagnósticos erróneos o inciertos. Por lo tanto, es importante considerar
alternativas diagnósticas, como la combinación de pruebas serológicas con
técnicas moleculares, o la inclusión de otros métodos diagnósticos que permitan
diferenciar con mayor exactitud estas enfermedades y mejorar así la precisión
en casos de coinfección.
En términos de
rendimiento, la prueba HAI Chagas POLYCHACO mostró una sensibilidad del 100 % y
una especificidad del 55,56 %, lo que la hace altamente sensible, pero con un
alto riesgo de generar falsos positivos. Esto significa que puede ser útil para
identificar a casi todos los pacientes infectados, pero con la limitación de no
ser lo suficientemente específica para diferenciar entre T. cruzi y otros parásitos. Por su parte, el test ELISA
Chagas III mostró una sensibilidad del 86,30 % y una especificidad del 98,61 %,
lo que indica que es más preciso en la identificación de casos no infectados.
Estos resultados son comparables con otros estudios realizados por Hurtado et
al. (22), Añez et al. (23) y Mamani (5).
Las variaciones en los resultados podrían deberse al uso de antígenos no
autóctonos en kits comerciales, lo que afecta la sensibilidad y especificidad (24).
Finalmente, el
análisis de concordancia entre la prueba HAI Chagas POLYCHACO y el Chagatest ELISA recombinante v.3.0 mostró un índice de
kappa moderada (0,56), lo que indica que, si bien ambas pruebas pueden detectar
la enfermedad, presentan ciertas discrepancias en sus resultados. En contraste,
la concordancia entre el test ELISA Chagas III y el Chagatest
ELISA recombinante v.3.0 fue muy buena (índice de kappa: 0,85), lo que indica
que ambos ofrecen resultados similares y podrían emplearse de manera
complementaria para mejorar la precisión diagnóstica. Además, el valor de p
fue de 0,000 lo que indica que existe una relación estadísticamente
significativa entre las pruebas evaluadas, por lo que se refuerza la relevancia
de utilizar estas pruebas serológicas en combinación para obtener un
diagnóstico más fiable. Los resultados obtenidos son consistentes con
investigaciones previas, como las de Hurtado et al. (22) y Aria et
al. (24).
Una de las
limitaciones de este estudio fue la imposibilidad de incluir muestras
provenientes de diversas regiones de Bolivia, lo que restringe la
generalización de los resultados a nivel nacional. Esta falta de
representatividad geográfica limita la validez externa del estudio, ya que no
se puede asegurar que los resultados sean aplicables a toda la población
boliviana, especialmente en áreas con diferentes prevalencias o características
socioambientales particulares.
Se recomienda
continuar con estudios comparativos que incluyan diferentes poblaciones y
condiciones locales, para optimizar los protocolos diagnósticos y reducir las
limitaciones observadas.
Conclusiones
En conclusión,
los resultados obtenidos en este estudio subrayan la importancia de combinar
diferentes pruebas serológicas para mejorar el diagnóstico de la enfermedad de
Chagas. La HAI Chagas POLYCHACO (Argentina), con su alta sensibilidad, es útil
para detectar casos positivos, pero su baja especificidad puede llevar,
asimismo, a falsos positivos. El test ELISA Chagas III (Laboratorios BiosChile) muestra, por su parte, una mayor especificidad,
pero con una menor sensibilidad. Las reacciones cruzadas con otros parásitos
siguen siendo un desafío, aunque las pruebas de ELISA tienen un mejor desempeño
en este aspecto. La concordancia entre las pruebas sugiere que la combinación
de pruebas podría mejorar la precisión del diagnóstico, especialmente en
regiones donde coexisten múltiples infecciones parasitarias.
Agradecimientos
Al Laboratorio
de Análisis Clínico OMEGALAB de la Ciudad de Cochabamba (Bolivia), por
proporcionarnos el material biológico (sueros) y por permitirnos realizar esta
investigación.
REFERENCIAS
- Martínez DST, Ramírez
JJQ, Monroy-Díaz ÁL. Diagnóstico
de la Enfermedad de Chagas congénito:
Aspectos relevantes.
Rev Médica Risaralda [Internet]. 2 de agosto de 2023 [Consultado
el 18 de enero de 2025];29(1). Disponible
en: https://revistas.utp.edu.co/index.php/revistamedica/article/view/25093
- Cervantes-Landín AY,
Martínez-Martínez I, Reyes PA, Shabib M,
Espinoza-Gutiérrez B. Estandarización de la técnica Dot-ELISA
para la detección de anticuerpos anti- trypanosoma
cruzi y su comparación con ELISA y Western blot. Enfermedades Infecc Microbiol Clínica [Internet]. 1 de junio de 2014
[Consultado el 18 de enero de 2025];32(6):363-8. Disponible en: https://www.sciencedirect.com/science/article/pii/S0213005X13001699
- Cruz Alegría IY, Gutiérrez Ruiz JA, Cortés Ovando
D, Hernández Nancy GS, Ruiz Castillejos C, Gómez Cruz A, et al.
Prevalencia y conocimiento de la enfermedad de Chagas en dos comunidades
del sureste de México. Rev Bioméd.
[Internet]. 2021 [Consultado el 18 de enero de 2025];32(2):106-12.
Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=7980542
- Organización Mundial de Salud. Enfermedad de
Chagas (tripanosomiasis americana) [Internet]. Ginebra: Organización
Mundial de la Salud; 2 de abril de 2025 [Consultado el 18 de enero de
2025]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis)
- Mamani JI, Collino CJG.
Comparación de dos métodos para la determinación de anticuerposanti
Trypanosoma cruzi
incorporando un sistema documental. Bioquímica Patol Clínica [Internet].
2021 [Consultado el 20 de abril de 2024];85(3):44-50. Disponible en: https://www.redalyc.org/journal/651/65171751006/html/
- Irurtia
MC, Magdaleno MA, Peluffo G, Bartolomeo
SD, Montenegro G. Detección molecular de Trypanosoma
cruzi. Experiencia en un hospital público. Rev Bioquímica Patol Clínica [Internet]. 2018
[Consultado el 18 de enero de 2025];82(1):27-33. Disponible en: https://www.revistabypc.org.ar/index.php/bypc/article/view/79
- Concha Valdez FG. Diagnóstico serológico de la
enfermedad de chagas (chagas
congénito y en donantes de sangre): Validación del antígeno hierro superóxido dismutasa
excretada (fe-sode) de trypanosoma
cruzi [Internet]. Granada: Universidad de
Granada; 2015 [Consultado el 18 de enero de 2025]. Disponible en: https://dialnet.unirioja.es/servlet/tesis?codigo=57249
- Moser MS, Fleischmann CJ, Kelly EA, Townsend RL, Stramer SL, Bern C, et al. Evaluation of InBios Chagas Detect Fast, a Novel Enzyme-Linked
Immunosorbent Assay for the Detection of Anti-Trypanosoma
cruzi Antibodies. J Clin Microbiol. [Internet].
28 de febrero de 2023 [Consultado el 22 de enero de 2025];61(3):e01762-22. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10035310/
- Villca-Chuquichambi
M, Condori-Mamani A, Orellana-Guevara R, Orellana-Salazar J. Frecuencia y
conocimiento de tripanosomiasis americana en habitantes de la municipalidad
de Vinto, Cochabamba, Bolivia. Rev Exp En Med Hosp Reg
Lambayeque [Internet]. 25 de septiembre de 2024 [Consultado el 4 de enero
de 2025];10(3). Disponible en: https://rem.hrlamb.gob.pe/index.php/REM/article/view/774
- Graterol D, Contreras V. Comparación de Trypanosoma cruzi de
diferente procedencia epidemiológica para el inmunodiagnóstico
de la enfermedad de Chagas. SABER [Internet]. 1 de agosto de 2019
[Consultado el 4 de enero de 2025];31:315-23. https://doi.org/10.5281/zenodo.5551246
- Escalante H, Jara C, Davelois
K, Iglesias M, Benites A, Espinoza R. Estandarización de la técnica de
western blot para el diagnóstico específico de
la enfermedad de Chagas utilizando antígenos de excreción-secreción de los
epimastigotes de Trypanosoma
cruzi. Rev Peru Med Exp
Salud Publica [Internet]. Octubre de 2014 [Consultado el 29 de agosto de
2023];31(4):644-51. Disponible en: http://www.scielo.org.pe/scielo.php?script=sci_abstract&pid=S1726-46342014000400005&lng=es&nrm=iso&tlng=es
- Viettri
M, Lares M, Medina M, Herrera L, Ferrer E. Evaluación de estuches
comerciales para el diagnóstico inmunológico y molecular de la enfermedad
de Chagas en zonas endémicas de Venezuela. Enfermedades Infecc Microbiol Clínica
[Internet]. 1 de febrero de 2022 [Consultado el 14 de junio de
2025];40(2):82-5. Disponible en: http://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-articulo-evaluacion-estuches-comerciales-el-diagnostico-S0213005X20302974
- Kelly EA, Bulman CA, Gunderson EL, Irish AM,
Townsend RL, Sakanari JA, et al. Comparative
Performance of Latest-Generation and FDA-Cleared Serology Tests for the
Diagnosis of Chagas Disease. J Clin
Microbiol. [Internet]. 19 de mayo de 2021
[Consultado el 14 de junio de 2025];59(6):10.1128/jcm.00158-21. https://doi.org/10.1128/jcm.00158-21
- Whitman JD, Bulman CA, Gunderson EL, Irish A,
Townsend RL, Stramer S, et al. Chagas
Disease Serological Test Performance in U.S. Blood Donor Specimens. J
Clin Microbiol.
[Internet]. 2019 [Consultado el 1 de junio de 2025];57. Disponible en: https://consensus.app/papers/chagas-disease-serological-test-performance-in-us-blood-whitman-bulman/5d420a70d84d5623a27353023ab588a8/
- Tandaypán
AV, Añorga HE, Benites A. Comparación de
antígenos de excreción-secreción de epimastigotes
(ESEA) y tripomastigotes (TESA) de Trypanosoma cruzi mediante
Western blot para el diagnóstico de la
enfermedad de Chagas. REBIOL. [Internet]. 2015 [Consultado el 21 de enero
de 2025];35(2):53-61. Disponible en: https://revistas.unitru.edu.pe/index.php/facccbiol/article/view/1076
- Llano M, Pavía P, Flórez AC, Cuéllar A, González
JM, Puerta C. Evaluación preliminar de la prueba comercial Chagas (Trypanosoma cruzi) IgG-ELISA® en individuos colombianos. Biomedica [Internet]. 2014 [Consultado el 21 de enero
de 2025];34(2):228-36. Disponible en: http://www.scopus.com/inward/record.url?scp=84904398871&partnerID=8YFLogxK
- Acosta-de Hetter ME,
Aria L, Guillén I de, Rojas A, Infanzón B, Cantero C, et al. Rendimiento
del Kit de Chagas V2.0 IICS-UNA para el tamizaje de la enfermedad. Mem Inst Invest
Cienc Salud Impr
[Internet]. 2022 [Consultado el 21 de enero de 2025];20(3):6-12. https://doi.org/10.18004/mem.iics/1812-9528/2022.020.03.06
- Studocu.
HAI Chagas Polychaco - inserto - Manual de
Instrucciones HAI CHAGAS POLYCHACO PRUEBA DE [Internet]. [Consultado el 5
de julio de 2025]. Disponible en: https://www.studocu.com/es-ar/document/universidad-de-buenos-aires/microbiologia-y-parasitologia-i/hai-chagas-polychaco-inserto/73234622
- SCRIBD. Test de Elisa para Chagas [Internet].
[Consultado el 5 de julio de 2025]. Disponible en: https://es.scribd.com/document/401602492/TEST-DE-ELISA-PARA-CHAGAS
- SCRIBD. Chagatest ELISA
Recombinante v3 0 SP [Internet]. [Consultado el 5 de julio de 2025].
Disponible en: https://es.scribd.com/document/614993616/chagatest-elisa-recombinante-v3-0-sp
- Alviarez
Y, Lares M, Viettri M, Aguilar CM, Herrera L,
Ferrer E. Estandarización de la técnica de aglutinación directa para el inmunodiagnóstico de la enfermedad de Chagas.
Biomédica [Internet]. Junio de 2014 [Consultado el 11 de julio de 2023];34(2):308-17.
http://dx.doi.org/10.7705/biomedica.v34i2.2078
- Manuel HCJ, Elena D la CFM, Teresa MCM, Idalia
SG, Celia RME. Concordancia entre ELISA y hemaglutación
indirecta: Un ejercicio para la selección de la prueba diagnóstica en el
tamizaje serológico de la Enfermedad de Chagas. Bioquimia
[Internet]. 2006 [Consultado el 20 de abril de 2024];31(SA):85. Disponible
en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=8667
- Añez N, Romero M, Crisante
G, Bianchi G, Parada H. Valoración comparativa de pruebas serodiagnósticas utilizadas para detectar enfermedad
de Chagas en Venezuela. Bol Malariol Salud Ambient [Internet]. Julio de 2010 [Consultado el 11 de
julio de 2023];50(1):17-27. Disponible en: http://ve.scielo.org/scielo.php?script=sci_abstract&pid=S1690-46482010000100003&lng=es&nrm=iso&tlng=es
- Aria L, Acosta ME, Guillen Y, Rojas A, Meza T,
Infanzón B, et al. Desempeño del Kit ELISA Chagas IICS V.1 para el
diagnóstico de la enfermedad de Chagas. Mem Inst Investig En Cienc Salud [Internet]. diciembre de 2016 [Consultado
el 11 de julio de 2023];14(3):7-13. https://doi.org/10.18004/mem.iics/1812-9528/2016.014(03)07-013
